Česká a slovenská psychiatrie

Časopis
Psychiatrické společnosti ČLS JEP
a Psychiatrickej spoločnosti SLS
souborný článek / review article
VZTAHY MEZI NĚKTERÝMI GENETICKÝMI POLYMORFISMY A KLINICKÝMI RYSY U ALZHEIMEROVY CHOROBY
RELATIONSHIPS BETWEEN SOME GENETIC POLYMORPHISMS AND CLINICAL FEATURES OF ALZHEIMER´S DISEASE
Ada Manukyan, Roman Jirák
Psychiatrická klinika, 1. lékařská fakulta, Univerzita Karlova v Praze a Všeobecná fakultní nemocnice v Praze, Praha, Česká republika
SOUHRN
Manukyan A, Jirák R. Vztahy mezi některými genetickými polymorfismy a klinickými rysy u Alzheimerovy choroby
Etiopatogeneze Alzheimerovy choroby není dosud uspokojivě vysvětlena. Na vzniku se podílejí jak faktory genetické, tak i jiné faktory vnitřního prostředí a faktory vnějšího prostředí. V současnosti je věnován velký zájem genetice, uvažuje se o tom, že Alzheimerova choroba je polygenně podmíněná spolu s faktory vnějšího prostředí.
V článku je uveden nekompletní přehled v současnosti nejsledovanějších genetických faktorů Alzheimerovy choroby. Na rozvoji této neurodegenerace se mohou podílet jak mutace, tak také řada polymorfismů. Některé polymorfismy mohou sloužit jako spouštěče neurodegenerace, jiné mohou modifikovat klinický obraz a průběh choroby.
V genetice jsou důležité asociační studie, které slouží především k odhalování genetické predispozice k multífaktoriálním onemocněním, tedy genů (přesněji řečeno genotypů složených z různých alel daných genů), které zvyšují nebo snižují riziko onemocnění. Takové genotypy poznáme relativně jednoduše - vyskytují se významně častěji nebo naopak významně méně často ve skupině nemocných (případů) v porovnání se skupinou zdravých (ve smyslu netrpících danou nemocí) kontrol.
Klíčová slova: Alzheimerova choroba, asociační studie, genové mutace, polymorfismy, genetické faktory Alzheimerovy choroby, poruchy chování
SUMMARY
Manukyan A, Jirák R. Relationships between some genetic polymorphisms and clinical features of Alzheimer´s disease
An article gives an overview of the currently most-watched genetic factors of Alzheimer´s disease.
The main hypothesis is: certain genetic polymorphisms influence the development and course of the clinical picture of Alzheimer´s disease. Purpose of the study is figuring out how polymorphisms modify the clinical picture of dementia, how certain clinical features correlate with certain genetic abnormalities.
Knowing the connection between genetic polymorphisms and clinical features (such as the predominant behavior disorders, activities of daily living, mood disorders) and genetic examination of polymorhisms in turn would lead to improve diagnosis and therapy of the disease.
Also discovery of a new polymorphism influencing the emergence of a clinical picture AD, would mean the inventing a new biomarker AD, which would serve to early diagnosis and early initiation of therapy at a stage before the onset of dementia.
In the genetics, there are important Genome-wide association studies (GWAS), which are useful first of all for identifying of genetic susceptibility for multifactorial diseases - genes (or genotypes constitued from other allelas of this genes), which increased or decreased of risk of disease. Such gebnotypes we find relatively simply - they occur significantly often or significantly scarcely ever. In the group of patients in comparison with the control group of healthy people.
Key words: Alzheimer´s disease, associative studies, mutations of genes, polymorphisms, genetic factors of Alzheimer´s disease, behavioural disturbances
ÚVOD
Alzheimerova choroba je těžké neurodegenerativní onemocnění, vedoucí k rozvoji demence. Je to, co do četnosti, první příčina demence vůbec. Alzheimerova choroba je proces nevratný a progresivní. Onemocnění postihuje paměť a další kognitivní funkce, ale vede také k dalším problémům, jako je zmatenost, změny nálady a chování (behaviorální a psychologické příznaky demence) a k těžkým poruchám aktivit denního života, ke ztrátě soběstačnosti. Ačkoli je známo vice patogenetických článků, není známa kauzalita Ach, není jasné, co přímo spoušti proces neurodegenerace. Existuje však celá řada genetických mutací a polymorfismů, které mohou vést ke spouštění a modifikaci alzheimerovské neurodegenerace.
Současná medicína tuto chorobu doposud nedovede účinně léčit, pouze poněkud zpomalit její postup. Dosud není známa etiopatogeneze Alzheimerovy choroby, ale je známa řada patogenních článků. Mezi ně patří i genetické faktory. Některé mutace vedou ke vzniku familiární Ach, ale toto je poměrně vzácné. (Jsou to vesměs formy s časným začátkem, kdy se demence manifestuje před 65. rokem života.) Familiárních případů Alzheimerovy choroby však je celkově málo, v různých souborech pacientů od zlomků procenta do několika procent. Je však známo, že některé polymorfismy mohou modifikovat vznik Ach, ovlivňovat chování a náladu, jsou to významné rizikové faktory. Na nejčastěji se vyskytující sporadickou formu Ach (forma s pozdním začátkem, manifestující se jako demence od 65 let života výše) je nyní pohlíženo také jako na možnou polygenně podmíněnou chorobou se spolupůsobením faktorů zevního prostředí.
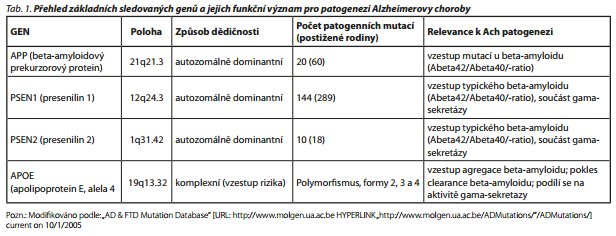
ZNÁMÉ GENOVÉ MUTACE U ACH
Víme, že u Ach dochází k tvorbě a následnému ukládání beta-amyloidu extracelulárně ve formě amyloidových plak Beta-amyloid je tvořen z přirozeného transmembránového proteinu - amyloidového prekurzorového proteinu (APP). APP je geneticky zakódován na dlouhém raménku 21. chromosomu. APP je extracelulárně štěpen pomocí enzymů alfa- a gama-sekretázy na štěpy o délce do 39 AMK (beta-peptid, P3). Tyto štěpy jsou plně solubilní a mají své fyziologické role, zřejmě neuroprotektivní. Je to tzv. neamyloidní cesta štěpení APR U Ach dochází k tomu, že je APP extracelulárně štěpen převážné beta- a gama-sekretázami na fragmenty o délce 40-42 AMK. Hovoříme o amyloidní cestě štěpení APRTyto fragmenty oligomerují, a následně vzniklé oligomery jsou velmi neurotoxické. Posléze oligomery polymerují do fibril, koagulují v extracelulárních prostorách kortexu a tvoří základy útvarů tzv. amyloidových plak. Plaky jsou pak okrsky, ze kterých se síří celá neurodegenerativní kaskáda: vzniká nadměrné množství volných kyslíkových a dusíkových radikálů, uvolňují se prozánětlivé cytokiny, excitační aminokyseliny, dochází k aktivaci gliových element, které produkují molekuly butyrylcholinesterázy, podílející se dále na známém acetylcholinergním deficit u Ach.
Existuji poměrně vzácné familiární případy Ach, u kterých jsou zjišťovány mutace presenilinu. Gen pro presenilin 1 (transmembránový protein, který je součásti gama-sekretáz) je zakódován na chromosomu 14. Tyto mutace zodpovídají asi za 80% všech případů Ach s časným začátkem.27
Na chromosomu 1 je zakódován presenilin 2 (transmembránový protein, který je součástí gama-sekretázy). Jeho mutace zodpovídají asi za 5% Ach s časným začátkem. Na dlouhém raménku chromosomu 21 je zakódován amyloidový prekurzorový protein. Jeho mutace představují asi 25 % případů familiární Ach.
U Ach s časným začátkem jsou uvedené poruchy přenášeny autosomálně dominantním způsobem, ale vlivem epigenetických faktorů se může geneticky přenos modifikovat.
Jsou hledány další genetické faktory, které by se mohly spoludílet. Je to například gen kódující tau-protein na chromosomu 17/MAPT/, nebo gen pro BACE1 (beta-sekretáza).
POLYMORFISMY
Nejznámější z těchto genetických polymorfismů je apolipoprotein Eepsilon. Apolipoprotein Eepsilon má 3 izoformy (genetický polymorfismus): alely 2, 3 a 4. Přítomnost alely 2 je pokládána, především v homozygotní formě 2/2, za protektivní. Alela 3, nejčastěji se vyskytující v naší populaci, se pokládá ve vztahu k Ach za indiferentní. Alela 4 představuje rizikový faktor Alzheimerovy choroby, a to i v heterozygotní formě, ale obzvlášť v homozygotní alelické kombinaci 4/4. Dle výsledku různých studii zvyšuje přítomnost jedné alely ApoE4 pravděpodobnost výskytu Ach až třikrát, přítomnost 2 alel (4/4) až patnáctkrát. Tato izoforma 4 představuje rizikový faktor Ach s pozdním začátkem (sporadické Alzheimerovy choroby), není však nezbytnou podmínkou vzniku Ach.1
Analogické rozložení bylo zjištěno u souboru pacientů s Ach vyšetřených na naší klinice v rámci výzkumného záměru, kde v souboru 75 pacientů trpících Alzheimerovou chorobou byla u 55 % zjištěna přítomnost alespoň jedné alely ApoE4 (13 % byli heterozygotní nosiči ApoE 4/4). V kontrolní skupině zdravých věkově srovnatelných osob byl výskyt jedné alely ApoE4 21 %, nevyskytli se homozygoti 4/4.
DALŠÍ GENETICKÉ FAKTORY U SPORADICKÉ ALZHEIMEROVY CHOROBY
Gen SORL1 (sortilin-related receptor L) kódovaný na dlouhém raménku 11. chromosomu vytváří jednonuklidové polymorfismy Produkt je mozaikový protein, sloužící jako multifunkční receptor, podílí se na uptake lipoproteinů a proteáz. Váže LDL v plazmě a přenáší endocytózou do buněk. Hraje roli v mezibuněčné interakci. Účastní se dopravy APP z a do Golgiho aparátu. Chrání APP od amyloidní cesty rozkladu, působí tedy preventivně proti tvorbě amyloidu beta 40-42. Gen je uložen na q-raménku 11. chromosomu. Nedostatek SORL1 zhoršuje příznaky Alzheimerovy choroby, a snad může být i spouštěčem.
SORL1
Degenerace tau-proteinu u Ach - genetické faktory nejsou zatím dostatečně objasněny, ale existuje polymorfismus tau - je známo šest izoforem, z nichž některé mohou být fragilnější, náchylnější k hyperfosforylaci a tím k degeneraci s tvorbou neurofibrilárních tangles (uzlíčků). Gen je zakódován na 17. chromosomu.
BDNF (brain-derivered neurotrophic faktor) je jeden z mozkových růstových faktorů. Významně se účastní neuronální plasticity. Existuje polymorfismus na kodonu 66 - val/met substituce - nosiči jsou rizikoví pro vznik Ach (asi 35% populace). U nich jsou zjišťována větší depozita beta-amyloidu v mozku, snížení volumu hipokampů, snížení výkonnosti epizodické paměti, tedy základní atributy Alzheimerovy choroby.
Polymorfismus představuje nebezpečí zvláště v kombinaci s nositelstvím ApoE4 alely.28
BDNF
Gen pro alfa-2 makroglobulin - nedostatek této látky je často spojen s Ach - látka odstraňuje z depozit v mozku beta-amyloid.
Jiný rizikový faktor je polymorfismus genu pro alfa1-antichymotripsin (ACT). ACT má afinitu k beta-amyloidovým peptidům a výrazně zesiluje jejich polymeraci. Podporuje tak vznik amyloidních filament. U alzheimerovských pacientů je zjišťována overexprese ACT zvláště v oblastech, kde jsou největší depozita beta-amyloidu. Kombinace polymorfismu ACT/AA a ApoE4 představuje velké riziko pro vznik Ach.14,15
Další rizikový polymorfní gen je CD33. Je to transmembránový protein, imunoglobulinům podobný lektin, který váže kyselinu křemičitou. U Ach je signifikantně zvýšená exprese CD33. Jeden z polymoerfismů, malá alela CD33SNPrs3865444, je protektivní vůči Ach. Je spojena se snížením exprese a tím tvorby CD33. CD33 pozitivně koreluje s množstvím nerozpustného amyloidu beta. Tento protein je exprimován v mikroglii. Inaktivace CD33 je možný terapeutický přístup u Ach.
Polymorfismus v genu pro interleukin 10 (IL-10) - nositelé rizikových alel jsou náchylnější ke vzniku Ach asi o 27 % častěji u evropské populace, ale nikoli u asijské populace.
Interleukin 10 se účastní zánětu u Alzheimerovy choroby. Je zkoumáno více polymorfismu jiných zánětlivých cytokinů, např. TNFalfa (tumor necrosis factor).30
Reelin je glykoprotein, který reguluje migrace a umístění nervových buněk během fetálního a raného postnatálního vývoje, které jsou nezbytné pro normální vývoj mozkové kůry a dalších mozkových struktur. V dospělosti látka reguluje synaptickou plasticitu. Reelin je lokalizován na chromosomu 7. Nedostatek reelinu provokuje Alzheimerovu chorobu, aktivuje glykogen-syntázu kinázu beta, enzym, který se podílí na spouštění hyperfosforylace tau-proteinu.
Existuje několik mutací a polymorfismu. Není jasně, se kterou mutací souvisí Alzheimerova choroba.
Reelin se také podílí na kognitivním defektu u schizofrenie, autismu, psychotických depresi. Nedostatek reelinu je příčinou lisencefalonu (hladký mozek bez mozkových závitů).
V současnosti je zkoumáno více dalších genů se vztahem k Ach. Náleží sem např. polymorfismus proteinu GAB2, který se ukazuje jako rizikový faktor Ach s pozdním začátkem u euroamerické populace bělochů, ale nikoli u jiných ras.13 Rovněž tak gen NEDD9 - jeden z polymorfismu je spojen se zvýšeným rizikem Alzheimerovy choroby u bělochů, ale nikoli u Asiatů.10,20
GENETICKÉ FAKTORY OVLIVŇUJÍCÍ PORUCHY CHOVÁNÍ U ALZHEIMEROVY CHOROBY
Chování u AD může ovlivnit polymorfismus pro dopaminový D3 receptor. D3 receptory se nacházejí především v limbickém systému mozku a tím může polymorfismus ovlivňovat chování i emotivitu.31
Také ApoE4 gen je spojen s poruchami chování. Gen pro BDNF je rovněž spojen s poruchami chování. Polymorfismus pro serotoninový transportní protein také může ovlivňovat poruchy chování. Je sledováno několik dalších kandidátních genů.
ASOCIAČNÍ STUDIE U ALZHEIMEROVY CHOROBY
Genomové asociační studie (GWAS) jsou užitečné pro identifikaci společných genetických variant, které zvyšují genetickou náchylnost k Alzheimerově chorobě. Nedávné GWAS identifikovaly a potvrdily devět nových míst podezřelých z účasti na rozvoji Ach (kromě apoE, který je znám delší dobu). Jsou to ABCA7, BIN1, CD2AP, CD33, Clu, CR1, EPHA1, MS4A4 a PICALM. Mezi lety 2008 a 2011 se potvrdila nejen platnost dřívějších nálezů, ale také byly identifikovány nové geny.24
Jednonukleotidový polymorfismus (SNP) byl identifikován u genu spondinu (SPON1) , v drobných alelách, a byl významně spojen s pomalejším tempem poklesu replikace spondinu. SPON1 nebyl dříve spojován s rizikem Ach, avšak věrohodně s ní souvisí, protože genový produkt se váže na amyloidní prekurzorovýprotein a inhibuje jeho štěpení (3-sekretázou. Tyto údaje naznačují, že deficit SPON1 může být spojen s rychlostí kognitivního poklesu AD.32
TREM2
Sekvenční varianty, obsahující e4 alelu apolipoproteinu E, jsou spojovány s rizikem sporadické formy Alzheimerovy choroby s pozdním začátkem. Bylo objeveno několik vzácných variant ovlivňujících riziko časného začátku Alzheimerovy nemoci.
U 2261 Islanďanů byla získána řada genomů a identifikovány řady variant, které pravděpodobně ovlivňují funkci proteinu. Tyto varianty byly stanoveny v genomech u pacientů s Alzheimerovou chorobou i účastníků kontrolní skupiny a poté testovány pro spojení s Alzheimerovou chorobou. Replikační testy byly provedeny pomocí case-control studií ze Spojených států, Norska, Nizozemska a Německa. Také byly testovány na genetické ovlivnění kognitivních funkcí v populaci nepostižených starších osob.
Vzácná mutace (rs75932628-T) genu kódujícího spouštěcí receptor, který je vyjádřený na myeloidních buňkách 2 (TREM2), u kterých je předpoklad, že mají za následek substituci R47H, zvyšuje na Islandu významně riziko Alzheimerovy choroby (poměr šancí, 2,92; 95% interval spolehlivosti [CI]). Byla sledována asociace v dalších přídatných souborech (poměr šancí, 2,90; 95 %). Bylo také zjištěno, že nosiči rs75932628-T ve věku 80 až 100 let bez Alzheimerovy choroby měli horší kognitivní funkce než lidé bez této alely (P = 0,003).
Nálezy silně spojují variantní TREM2 s patogenezí Alzheimerovy choroby. Vzhledem k referované protizánětlivé roli TREM2 v mozku může substituce R47H vést ke zvýšené náchylnosti k Alzheimerově chorobě přes sníženou kontrolu zánětlivých procesů.23
PLD3
V poslední době při sekvenování celého exomu (WES) studie ukázaly, že vzácná varianta rs 145999145 složená z p.Val232Met nacházející se v exonu 7 fosfolipázy D3 (PLD3) genu představuje zdvojené riziko pro pozdní nástup Alzheimerovy choroby (AD). Vyřazení PLD3 zvyšuje hladiny extracelulárního beta-amyloidu (Ap), což naznačuje, že PLD3 funguje jako negativní regulátor zpracování AP prekurzorového proteinu (APP). Nicméně, přesné buněčné umístění a rozložení PLD3 v mozku při Alzheimerově chorobě zůstává velkou neznámou.
Metodami kvantitativní RT-PCR (qPCR), western blotu, imunohistochemie a analýzy bioinformatiky byla zkoumána exprese PLD3 a hladiny u AD a mozků kontrolních osob, a také amyotrofické laterální sklerózy, Parkinsonovy nemoci, mnohočetné systémové atrofie, a u non-neurologických případů.
Hladiny PLD3 mRNA a exprese proteinu byly sníženy mírně v AD mozcích, ve srovnání s těmi v non-AD mozcích. Ve všech mozcích byl PLD3 exprimován konstitutivně v kortikálních neuronech, hipokampálních pyramidových neuronech a granulárních neuronech, ale ne v gliových buňkách. Pozoruhodné je, že PLD3 imunoreaktivita byla nahromaděna v neuritických plácích v AD mozcích. Lidský gen kódující progranulin (PRGN) vede k vytváření růstového mozkového faktoru granulinu. PLD3 byl vlastně koexprimován a interagoval s PGRN jak v kulturních buňkách in vitro, tak v AD mozcích in vivo.26
ZÁVĚR
Poznání souvislostí mezi jednotlivými genetickými polymorfismy a klinickými rysy (například převládající poruchy chování, poruchy aktivit denního života, poruchy nálady) a genetické vyšetření polymorfismů povede k zlepšení diagnostiky a terapie.
Také objevení dalšího polymorfismů, ovlivňujícího vznik a klinický obraz Ach, by znamenalo objevení nového biomarkeru Ach, což by sloužilo k včasné diagnostice a včasnému zahájeni terapie v preklinickém stadiu před vznikem demence.
V další práci se budeme zabývat výskytem jednotlivých polymorfismů a korelovat je s klinickými rysy demence a výsledky škál a dotazníkových metod. Použijeme asociační studie se stanovením genů pomocí čipů.
Seznam použitých zkratek
AD - Alzheimer's disease
Ach - Alzheimerova choroba
ACT - antichymotripsin
AMK - aminokyseliny
APOE - apolipoprotein
APP - amyloidový prekurzorový protein
BDNF - brain-derivered neurotrophic factor
IL-lO-interleukin-10
LDL - low-density lipoprotein
PSEN - presenilin
SORL - sortilin-related receptor L
TNF - tomor necrosis factor
GRN - granulin
PGRN - progranulin
GWAS - genomové asociační studie
SPON - spondin
LITERATURA
- 1. Roses AD. Apolipoprotein E alleles as risk factors in Alzheimer´s disease. Durham, North Carolina: Division of neurology, Department of Medicine, Duke University Medical Center; 1996
- 2. Adamczuk K, De Weer AS Nelidden N, Chen K, Sleegers K, Bettens K, Van Broeckhoven C, Vandenbulcke M, Thiyyagura P, Dupont P, Van Laere K, Reiman EM, Vandenberghe R. Polymorhism of brain derived neurotrophic factor influences beta-amylloid load in cognitively intact apolipoprotein Eepsilon 4 carriers. Neuroimage Clin 2013; 2: 512-520.
- 3. Bertram L, Tanzi R Genetics of Alzheimer´s disease. Neurodegeneration. The Molecular Pathology of Dementia and Movement Disorders. D. Dickson. Basel: ISN Neuropath Press; 2003.
- 4. Bertram L, Tanzi R. Alzheimer´s disease: one disorder, too many genes? Hum Mol Genet 2004; 13 Spec No 1: R135-141.
- 5. Bertram L, McQueen MB, Mullin K, Blacker D, Tanzi RE. Systematic meta- analyses of Alzheimer disease genetic association studies: the ALzGene database. Nat Genet 2007; 39: 17-23.
- 6. Bird TD, Pagon RA, Adam MP et al. Alzheimer Disease Overview. Seattle: University of Washington; 2013.
- 7. Cummings JL. Neuropsychiatric Inventory. Comprehensive Assessment of Psychopathology in Patients with Dementia, 2009.
- 8. Chourbaji S, Brandwein C, Gass P. Altering BDNF expression by genetics and/or enviroment: Impact for emotional and depression-like behavior in laboratory mice. Neurosci Biobehav Rev 2011; Jan; 35 (3): 599-611.
- 9. Farrer LA, Cupples LA et al. Effects of age, sex, and ethnicity on the association between apolipoprotein E genotype and Alzheimer disease. A meta-analysis. APOE and Alzheimer Disease Meta Analysis Consortium. Jama 1997; 278 (16): 1349-1356.
- 10. Fu Y, He F, Tang NL, Tarn CW, Lui VW, Chiu HF, Lam LC. NEDD9 gene polymorphism influences the risk of Alzheimer disease and cognitive function in Chinese older persons. Alzheimer Dis AssocDisord 2012; 26(1): 88-90.
- 11. Genetics Home Reference. BDNF. http://ghr.nlm.nih.gov/gene/BDNF
- 12. Genetics Home Reference. SORL1. http://ghr.nlm.nih.gov/gene/SORL1
- 13. Jin C, Wu CZ, Liu X, Zhang F, Tian L, Yuan J, Wang G, Cheng Z. GAB2 polymorphism rs2373115 confers susceptibility to sporadic Alzheimer´s disease. Neurosci Lett 2013; 556: 216-220.
- 14. Kamboh M. Apolipoprotein E polymorphism and susceptibility to Alzheimer´s disease. Hum Biol 1995; 67: 195-215.
- 15. Kamboh M, Dharambir K, Sanghera, Ferrell RE, DeKosky ST. A4APOE 4-associated Alzheimer´s disease risk is modified by alfa 1-antichymotrypsin polymorphism. Nature Genetics 1995; 10: 486-488.
- 16. National Institute of Aging. Alzheimer´s Disease Genetics Fact Sheet 2001. http://www.nia.nih.gov/alzheimers/publication/alzheimers-disease-genetics-fact-sheet
- 17. Rao AT, Degnan AJ, Levy LM. Genetics of Alzheimer Disease, 2012.
- 18. Scacchi R, De Bernardini L, Mantuano E, Donini LM, Vilardo T, Corbo RM. Apolipoprotein E (APOE) allele frequencies in late-onset sporadic Alzheimer´s disease (AD), mixed dementia and vascular dementia: lack of association of epsilon 4 allele with AD in Italian octogenarian patients. Neurosci Lett 1995; 201 (3): 231-234.
- 19. Treves TA, Bornstein NM, Chapman J, Klimovitzki S, Verchovsky R, Asherov A, Veshchev IO, Korczyn AD. APOE-epsilon 4 in patients with Alzheimer disease and vascular dementia. Alzheimer Dis Assoc Disord 1996; 10 (4): 189-191.
- 20. Wang Y, Bi L, Wang H, Li Y, Di Q, Xu W, Qian Y. NEDD9 rs 760678 polymorphism and the risk of Alzheimer´s disease: a meta-analysis. Neurosci Lett 2012; 527 (2): 121-125.
- 21. Wragg M. Hutton M. et al. Genetic association between intronic polymorphism in presenilin 1 gene and late-onset Alzheimer´s disease. Alzheimer´s Disease Collaborative Group. Lancet 1996; 347 (9000): 509-512.
- 22. Naj AC et al. Effects of multiple genetic loci on age at onset in late-onset Alzheimer disease: a genome-wide association study. JAMA Neurol 2014; 71(11): 1394-1404.
- 23. Jonsson T et al. Variant of TREM2 associated with the risk of Alzheimer´s disease. N Engl J Med 2013; Jan 10; 368(2): 107-116.
- 24. Cruchaga C et al. Rare coding variants in the phospholipase D3 gene confer risk for Alzheimer´s disease. Nature 2014; Jan 23; 505 (7484): 550-554.
- 25. Moskvina V et al. Analysis of Genome-Wide association studies of Alzheimer disease and of Partkinson disease to determine if these 2 diseases share a common genetic risk. JAMA Neurol 2013; Oct; 70 (10): 1268-1276.
- 26. Satoh et al. PLD3 is accumulated on neuritic plaques in Alzheimer´s disease brains. Alzheimers Res Ther 2014; Nov 2; 6 (9): 70.
- 27. Blacker D et al. Results of a high-resolution genome screen of 437 Alzheimer's disease families. Hum Mol Genet 2003; Jan 1, 12 (1): 23-32.
- 28. Voineskos AN et al. The brain-derived neurotrophic factor Val66Met polymorphism and prediction of neural risk for Alzheimer disease. Arch Gen Psychiatry 2011; Feb, 68 (2): 198-206.
- 29. Griciuc A et al. Alzheimer´s Disease Risk Gene CD33 Inhibits Microglial Uptake of Amyloid Beta. Neuron 2013; May 22, 78 (4): 631-643.
- 30. Arosio B et al. Interleukin-10 and inter-leukin-6 gene polymorphisms as risk factors for Alzheimer´s disease. Neurobiol Aging 2004; Sep, 25 (8): 1009-1015.
- 31. Sato N et al. Dopamine D3 receptor gene polymorphism influences on behavioral and psychological symptoms of dementia (BPSD) in mild dementia of Alzheimer´s type. J Alzheimers Dis 2009; 17 (2): 441-448.
- 32. Sherva R et al. Genome-wide association study of the rate of cognitive decline in Alzheimer´s disease. Alzheimers Dement 2014; Jan, 10 (1): 45-52.





