Česká a slovenská psychiatrie

Časopis
Psychiatrické společnosti ČLS JEP
a Psychiatrickej spoločnosti SLS
souborný článek / review article
VZÁJOMNÝ VZŤAH MEDZI ČREVNOU MIKROBIOTOU A VYBRANÝMI PSYCHOFARMAKAMI
THE RELATIONSHIP BETWEEN GUT MICROBIOTA AND SELECTED PSYCHOTROPIC DRUGS
Marcela Šoltýsová1,2, Aleksandra Tomova1, Daniela Ostatníková1
1 Fyziologický ústav, Akademické centrum výskumu autizmu LF UK, Bratislava, Slovenská republika
2 Detská psychiatrická ambulancia, Detská fakultná nemocnica s poliklinikou Banská Bystrica, Slovenská republika
2 Detská psychiatrická ambulancia, Detská fakultná nemocnica s poliklinikou Banská Bystrica, Slovenská republika
Súhrn
Šoltýsová M, Tomova A, Ostatníková D. Vzájomný vzťah medzi črevnou mikrobiotou a vybranými psychofarmakami
Vedecký záujem o interakciu črevnej mikrobioty s centrálnou nervovou sústavou prináša v posledných rokoch zaujímavé závery. Stovky druhov baktérií v ľudskom gastrointestinálnom trakte obojsmerne komunikujú s mozgom viacerými cestami. Prostredníctvom hlavnej vetvy parasympatikového nervového systému, ktorou je nervus vagus, ale aj cestou regulácie imunitného systému a tvorbou mastných kyselín s krátkym reťazcom zásadne ovplyvňujú jeho fungovanie. Naopak, centrálny nervový systém ovplyvňuje zloženie črevnej mikrobioty napríklad prostredníctvom osi hypotalamus-hypofýza-nadobličky (HPA os - hypothalamic-pituitary-adrenal axis). Potvrdilo sa, že črevná dysbióza má svoj podiel na etiopatogenéze duševných porúch, akými sú napríklad poruchy autistického spektra, depresívne a úzkostné poruchy, poruchy príjmu potravy, schizofrénia a demencie. Navyše, v posledných rokoch sa pozornosť vedy posunula aj k skúmaniu vzájomného vzťahu medzi mikrobiotou a psychofarmakami. Väčšina doteraz realizovaných štúdií bola zameraná na antipsychotiká a antidepresíva, určité dáta sú ale dostupné aj pre benzodiazepínové anxiolytiká, stabilizátory nálady, opioidné analgetiká, alkohol či iné psychoaktívne látky. Náš prehľadový článok má za cieľ poukázať na význam mikrobioty pre oblasť psycho-farmakológie, so zameraním sa na skupinu atypických antipsychotík a antidepresív. Ukazuje sa, že črevná mikrobiota má vplyv na farmakokinetiku a farmakodynamiku liečiv a naopak, nielen antibiotiká, ale aj lieky iných skupín menia zloženie mikrobioty. Tieto vzájomné interakcie môžu následne ovplyvniť terapeutickú odpoveď na liečbu alebo viesť k rozvoju nežiaducich účinkov. Súčasné poznatky tiež naznačujú možné budúce využitie probiotík a fekálnej mikrobiálnej transplantácie v prevencii rozvoja duševných porúch a v ich liečbe.
Klíčová slova: antidepresíva, antipsychotiká, črevná mikrobiota, os črevo-mozog, psychofarmaká
Summary
Šoltýsová M, Tomova A, Ostatníková D. The relationship between gut microbiota and selected psychotropic drugs
In recent years, the interest of science in the interaction between gut microbiota and central nervous system resulted in interesting findings. Hundreds of bacterial species in human gastrointestinal tract communicate with the brain by several pathways. Microbiota affects its functioning by the main nerve of parasympathetic division of central nervous system the vagus nerve, but also through regulation of the immune system and through production of short-chain fatty acids. Conversely, the central nervous system affects the composition of gut microbiota e.g. through the hypothalamic-pituitary-adrenal (HPA) axis. Gut dysbiosis has been shown to play a role in the etiopatho-genesis of mental disorders such as autism spectrum disorders, depressive and anxiety disorders, eating disorders, schizophrenia and dementia. In addition, the focus of science in recent years has shifted to explore the relationship between microbiota and psychotropic drugs. The vast majority of published studies have focused on antipsychotics and antidepressants, but preliminary data are available for benzodiazepine anxiolytics, mood stabilizers, opioid analgesics, alcohol and other psychoactive substances. Our review aims to highlight the importance of gut microbiota in the field of psychopharmacology, focusing on an atypical antipsychotics and antidepressants. The gut microbiota has been shown to affect the pharmacokinetics and pharmacodynamics of drugs and, conversely, not only antibiotics but also other drugs can alter the composition of microbiota. These interactions may subsequently alter the therapeutic response or lead to the development of side effects of the treatment. Current knowledge also suggests possible future importance of probiotics and fecal microbial transplantation in the prevention of the development of mental disorders or in its treatment.
Key words: antidepressants, antipsychotics, gut-brain axis, gut microbiota, psychotropic drugs
ÚVOD
Spotreba liekov určených na liečbu ochorení nervového systému v posledných rokoch na Slovensku stúpa. Podľa údajov Národného centra zdravotníckych informácií (NCZI) ide o druhú najčastejšie predpisovanú skupinu liekov, na prvom mieste sú lieky na kardiovaskulárny systém. V roku 2019 bolo predpísaných 14,3 mil. balení liekov na nervový systém, v roku 2017 to bolo 13, 7 milióna balení (NCZI, 2019).1 Do tejto skupiny patria aj psychofarmaká, lieky používané na liečbu duševných porúch. Vieme, že užívanie mnohých z nich je spojené s výskytom metabolických nežiaducich účinkov, so slabou terapeutickou odpoveďou, alebo vznikom rezistencie na liečbu. V posledných dvoch dekádach enormne vzrástol záujem vedeckej komunity o vzájomný vzťah medzi črevom a centrálnou nervovou sústavou (CNS). Vedecké štúdie odhalili výskyt biliónov mikroorganizmov v ľudskom gastrointestinálnom trakte (GIT), ktoré súhrnne označili pojmom črevná mikrobiota. V literatúre sa tento pojem často zamieňa s pojmom mikrobióm, ten však slúži na označenie genómu danej mikrobioty. Komunikácia medzi črevom a mozgom je obojsmerná a dostala pomenovanie "os mikrobiota-črevo-mozog". Táto signalizácia v sebe zahŕňa enterický nervový systém, autonómny nervový systém, imunitný a neuroendokrinný systém a ich správne fungovanie je nevyhnutné na zachovanie homeostázy organizmu. Doterajšie výskumy odhalili vplyv črevnej mikrobioty na mnohé funkcie ľudského tela. Potvrdil sa ich vplyv na bunky a gény hostiteľa, vplyv na imunitný, gastrointestinálny či kardiovaskulárny systém, ale aj na mozog a komplexné neurologické funkcie. Tento fakt privádza vedcov k úvahe označovať mikrobiotu za samostatný "orgán".2 Významný priestor sa venuje potenciálnemu vplyvu mikroorganizmov na vznik rôznych ochorení u človeka, avšak začína sa nahliadať na mikrobiotu nielen ako na pôvodcu ochorení, ale aj ako pôvodcu zdravia. Výsledky štúdií z posledných rokov naznačujú, že úloha mikroorganizmov v našich životoch je oveľa významnejšia, ako by sme očakávali. Dysbalancia črevnej mikrobioty sa dáva do súvislosti napríklad so vznikom refluxu, peptického vredu, syndrómu dráždivého čreva, obezity, aterosklerózy, diabetu II. typu, či alergických ochorení.3 Tiež bola potvrdená súvislosť medzi zmenami mikrobioty a duševnými poruchami, napríklad poruchami autistického spektra, depresiou, úzkostnými poruchami, schizofréniou, poruchami príjmu potravy alebo Alzheimerovou demenciou.4,5 Navyše, v poslednom desaťročí sa začali objavovať práce, ktoré opisujú vzájomný vzťah medzi črevnou mikrobiotou a metabolizmom a účinkom psychofarmák. In vitro aj in vivo štúdie preukázali, že nielen črevná mikrobiota ovplyvňuje funkcie mozgu, ale aj užívanie psychofarmák a psychotropných látok vedie k zmenám v zložení črevnej mikrobioty. Doterajšie práce v tejto oblasti sa venovali najmä vplyvu užívania vybraných druhov antipsychotík a antidepresív na mikrobiotu a možnému vplyvu mikrobioty na účinnosť a farmakokinetiku týchto liekov.
ČREVNÁ MIKROBIOTA
V priebehu evolúcie sa vytvoril symbiotický vzťah medzi rôznymi druhmi mikroorganizmov a človekom ako hostiteľským organizmom. Mikroorganizmy sa u človeka nachádzajú na povrchu aj vnútri tela. Sú prítomné na koži, na sliznici ústnej dutiny, v slinách, v gastrointestinálnom trakte, vaginálnej sliznici, ale aj na sliznici respiračného traktu a v spojovke. Najnovšie výskumy naviac dokázali prítomnosť baktérií v prsnej žľaze, uretre a močovom mechúre.6 Ľudský gastrointestinálny trakt obsahuje približne 3x1013 mikroorganizmov. Pre predstavu, u človeka s hmotnosťou 70 kg by ich hmotnosť mohla byť okolo 200 g.7 Okrem baktérií, ktoré sú najčastejšie skúmanými mikroorganizmami v GIT, je tento dynamický mikrobiálny ekosystém tvorený tiež vírusmi, archebaktériami, kvasinkami a jednobunkovými eukaryotmi. Poznať taxonomickú klasifikáciu črevných baktérií je kľúčové pri porozumení štúdiám pojednávajúcim o črevnej mikrobiote (obr. 1).

Hlavnými bakteriálnymi kmeňmi osídľujúcimi črevný trakt sú Bacteroidetes a Firmicutes, ktoré spolu tvoria asi 90 % celej mikrobioty.8 Dôležité je aj ich vzájomné pomerné zastúpenie, ktoré sa ukázalo byť významným markerom obezity a indexu telesnej hmotnosti (BMI - body mass index).2 V menšom množstve sú v GIT zastúpené kmene Proteobacteria, Actinobacteria, Fusobacteria, Verrucomicrobia a Cyanobacteria.3 Genetický materiál mikrobioty je asi 100x väčší ako ľudský genóm.9 Niektoré baktérie sú súčasťou tranzientnej flóry, iné majú tendenciu trvalo osídľovať tráviaci trakt. Distribúcia a zastúpenie jednotlivých bakteriálnych druhov sa líši v rôznych úsekoch GIT, pričom hustota ich výskytu je najvyššia v hrubom čreve.10 Súvisí to s kyslým prostredím žalúdka, črevnou peristaltikou, sekréciou IgA na sliznici, aktivitou imunitného systému a vplyvmi prostredia.3,11 Iné druhy baktérií dominujú v lumene čreva a iné na jeho sliznici, zároveň bola v lumene čreva opísaná vyššia diverzita.12,13 Na základe variácie v zastúpení troch hlavných bakteriálnych rodov bola navrhnutá klasifikácia mikrobioty do 3 enterotypov: Bacteroides (enterotyp 1), Prevotella (enterotyp 2) a Ruminococcus (enterotyp 3). Zdá sa, že tieto nie sú ovplyvnené vekom, pohlavím, BMI a ani geograficky.14
Diverzita mikrobioty narastá s vekom. Približne vo veku troch rokov dieťaťa je zloženie črevnej mikrobioty podobné jej zloženiu u dospelého jedinca.15 Tento proces je výsledkom zrenia ovplyvneného genetikou, spôsobom pôrodu a výživy novorodenca, infekciami prekonanými počas života, antibiotickou terapiou, ale aj kultúrnymi a stravovacími návykmi, životným štýlom, fyzickou aktivitou, prežívaným stresom a fyziológiou čreva.2,11,16 V priebehu starnutia opäť dochádza k poklesu jej diverzity, pravdepodobne zhoršením stravovania a trávenia, zmenami vo vstrebávaní živín a poklesom aktivity imunitného systému.11 U starých ľudí je opísaná prevaha kmeňa Bacteroidetes a rodu Clostridium, u mladých dospelých dominuje zastúpenie kmeňa Firmicutes.11,17 Mikrobiota plní v organizme množstvo funkcií, hrá zásadnú úlohu v trávení a metabolizme, črevnej peristaltike, udržiavaní optimálneho pH a integrity črevnej mukózy, ale napomáha tiež zrenie imunitného a nervového systému a chráni organizmus pred patogénmi.11,18
OS MIKROBIOTA-ČREVO-MOZOG
Ako teda prebieha komunikácia medzi črevom a mozgom? Vedci opísali viacero dráh tejto komunikácie, hoci presný mechanizmus signalizácie ešte stále nie je plne objasnený. Enterický systém ako vetva autonómneho nervového systému bol kedysi označovaný za "druhý mozog" ľudského tela. A to vďaka porovnateľnosti s mozgom vo svojej veľkosti, komplexnosti, neurotransmiteroch a signálnych molekulách. Tento systém pozostáva z 200 až 600 miliónov neurónov (senzorických, motorických a interneurónov), čo je počet, ktorý zodpovedá počtu neurónov v spinálnej mieche. Plocha sliznice črevného traktu má väčší povrch, ako je celková plocha ľudskej kože. Takzvané s črevom asociované lymfoidné tkanivo (GALT - gut associated lymphoid tissue) tvorí asi % všetkých imunitných buniek tela s tisíckami enteroendokrinných buniek produkujúcich viac ako 20 známych hormónov.19 Viaceré prehľadové práce opísali cesty vzájomnej komunikácie medzi črevom a CNS.20-22 Významnou je hlavná vetva parasympatikového nervového systému nervus vagus, ktorý inervuje vnútorné orgány - srdce, pľúca, pečeň, pankreas, žalúdok a črevá. Opisuje sa vzájomná stimulácia medzi nervus vagus a črevnými baktériami s následným ovplyvnením komplexných funkcií mozgu a behaviorálnych prejavov. Je známe, že určité druhy baktérií zvyšujú produkciu prozápalových cytokínov (napr. TNF-?, IL-1?, IL-6) , ktoré pôsobia buď priamo na nervus vagus, alebo po prestupe do krvného obehu ovplyvňujú integritu hematoencefalickej bariéry a umožnia tak prestup týchto molekúl do CNS. Animálne štúdie preukázali zmeny v správaní u zvierat po podaní prozápalových cytokínov v zmysle redukcie príjmu potravy, poklesu aktivity, sociálnych a sexuálnych interakcií a exploračného správania. Funkciu mediátorov medzi črevom a mozgom plnia aj mastné kyseliny s krátkym reťazcom (tzv. SCFAs - short chain fatty acids), ktoré sú produktami bakteriálnej fermentácie v čreve. Kyselina maslová a kyselina propiónová zvyšujú expresiu génu pre tyrozín hydroxylázu, čo v konečnom dôsledku vedie k zvýšenej syntéze dopamínu a noradrenalínu. Kyselina propiónová ovplyvňuje aj sérotonínergickú transmisiu, znižuje hladinu gama-aminomaslovej kyseliny (GABA), sérotonínu a dopamínu v in vivo experimentoch. SCFAs majú dôležitú úlohu v regulácii mikroglie, ktorá je nevyhnutná pri vyzrievaní mozgu, oprave poškodení, udržiavaní integrity hematoencefalickej bariéry a ako podpora neuronálnych sietí. U sterilných myší boli potvrdené defekty v mikroglii s následným oslabením vrodenej imunity. Dôležitou súčasťou komunikácie črevo-mozog sú enteroendokrinné bunky v sliznici GIT. Pôsobením rôznych stimulov uvoľňujú neuroaktívne peptidy, ako sú glukagónu podobný peptid 1 (GLP-1), cholecystokinín (CCK) a peptid YY (PYY), ktoré v organizme plnia viacero funkcií. Ovplyvňujú napríklad črevnú motilitu, sekréciu v čreve, metabolizmus, a podieľajú sa tiež na regulácii emócií a stresovej odpovede. Na uvoľňovanie hormónov regulujúcich príjem potravy z enteroendokrinných buniek majú vplyv aj samotné SCFAs. Štúdie preukázali odlišný počet enteroendokrinných buniek a nižšiu hladinu GLP-1, PYY a CCK u sterilných myší. Proteíny vylučované E. coli, ale tiež kyselina propiónová a prebiotiká stimulujú uvoľňovanie GLP-1 a PYY. Podávanie prebiotík u ľudí navyše viedlo k zníženiu hladiny grelínu. Následkom uvedených mechanizmov dochádza k posilneniu sýtosti a zníženiu pocitu hladu. Vzťah medzi HPA osou a mikrobiotou je tiež významnou dráhou spájajúcou CNS a GIT. Táto dráha je zodpovedná za stresovú reakciu a jej aktivácia spôsobuje uvoľňovanie glukokortikoidov z kôry nadobličiek. Výskumne sa potvrdili vyššie hladiny adrenokortikotropného hormónu (ACTH) u sterilných myší v reakcii na stresový podnet v porovnaní s bežne kolonizovanými myšami. Táto prehnaná odpoveď sa znormalizovala po rekolonizácii sterilných myší fekálnym transplantátom. Ukazuje sa, že aj podávaním pre- a probiotík (Lactobacillus salivarius a Lactobacillus farmicinis) dochádza k slabšej aktivácii HPA osi po aplikácii stresového podnetu.
Mikrobiota dokáže priamo produkovať viaceré neurotransmitery a neuromodulátory alebo nepriamo ovplyvňovať koncentráciu neurotransmiterov v CNS ovplyvnením dostupnosti a metabolizmu ich prekurzorov. Niektoré druhy rodov Streptococcus, Escherichia, Enterococcus a Candida syntetizujú 5-hydroxytryptamín, druhy rodu Escherichia, Bacillus a Saccharomyces zase dopamín a noradrenalín, niektoré druhy laktobacilov tvoria acetylcholín a druhy laktobacilov a bifidobaktérií produkujú GABA.20-22
VZŤAH MEDZI MIKROBIOTOU A PSYCHOFARMAKAMI
V posledných rokoch preniklo skúmanie úlohy mikrobioty aj do oblasti farmakológie, táto oblasť dostala pomenovanie "farmakomikrobiomika". Jej hlavným zámerom je sledovanie vplyvu mikrobioty na metabolizmus liečiv. Narastajúci počet výskumov ukazuje, že okrem antibiotík, ktoré priamo menia zloženie črevnej mikrobioty, môžeme tento efekt prisúdiť aj ďalším farmakám, ako sú napríklad paracetamol, digoxín, metformín, inhibítory protónovej pumpy, nesteroidné antiflogistiká, ale aj lieky na onkologické ochorenia.23,24 Vzájomný vzťah mikrobioty a psychofarmák závisí od viacerých premenných. Dôležitý je počet a druh užívaných liekov. U starších hospitalizovaných pacientov sa preukázala negatívna korelácia medzi počtom užívaných liekov a alfa-diverzitou (rozmanitosťou bakteriálnych druhov) mikrobioty. Dokázala sa aj súvislosť medzi počtom užívaných liekov a pomerom zastúpenia jednotlivých bakteriálnych kmeňov. U inhibítorov protónovej pumpy, antidepresív a antipsychotík sa preukázal tento efekt ako najsilnejší.25 Naopak, mikrobiota má preukázateľný vplyv na účinnosť a toxicitu liekov.26 Mikrobiota dokáže syntetizovať enzýmy na biotransformáciu chemických látok, čím môže byť ovplyvnená tvorba jednotlivých metabolitov. Napríklad, štúdie na sterilných myšiach preukázali nižšie hladiny CYP3A a vyššie hladiny CYP4A v porovnaní s bežne kolonizovanými myšami.27 Tieto a iné enzýmy podrodiny cytochrómu P450 3A predstavujú významnú skupinu enzýmov, ktorými sa metabolizuje viac než 50 % všetkých liečiv. Vedci z uvedených poznatkov vyvodzujú, že aj v ľudskom organizme môže mať zloženie mikrobioty vplyv na interindividuálne rozdiely v expresii CYP3A s následným vplyvom na metabolizmus liekov a produkciu aktívnych a toxických metabolitov. Napríklad, podávanie antibiotík pred podaním benzodiazepínu nitrazepamu významne zredukovalo produkciu toxického metabolitu 7-aminonitrozepamu a výskyt vrodených malformácií u mláďat potkanov.28 V staršej animálnej štúdii sa preukázal vplyv mikrobioty na hepatotoxicitu inhibítora cholínesterázy takrínu. Štúdia na pacientoch s Parkinsonovou chorobou užívajúcich levodopu a zároveň potvrdenou infekciou H. pylori preukázala vyššie plazmatické hladiny levodopy po eradikácii H. pylori antibiotikami v porovnaní s kontrolnou skupinou. Autori ďalšej práce opísali zvýšenú citlivosť systému odmeny na podanie psychostimulačnej drogy kokaínu po redukcii mikrobioty predchádzajúcim podávaním antibiotík.4
ATYPICKÉ ANTIPSYCHOTIKÁ A ČREVNÁ MIKROBIOTA
Antipsychotiká sú lieky určené najmä na liečbu psychotických porúch, avšak sú často používané aj ako augmentačná a off-label liečba pri iných duševných poruchách.29 Častou a obávanou komplikáciou v liečbe je vznik metabolického syndrómu, ktorý je definovaný ako prítomnosť minimálne 3 z nasledujúcich 5 znakov - abdominálna obezita, nízky HDL cholesterol, zvýšené triglyceridy v sére, hypertenzia a zvýšená glykémia nalačno. Metabolický syndróm je tak významným ukazovateľom kardiovaskulárneho rizika a rizika vzniku diabetu, a spolu s fajčením cigariet tvorí významný faktor podieľajúci sa na mortalite pacientov so schizofrénnym ochorením.30
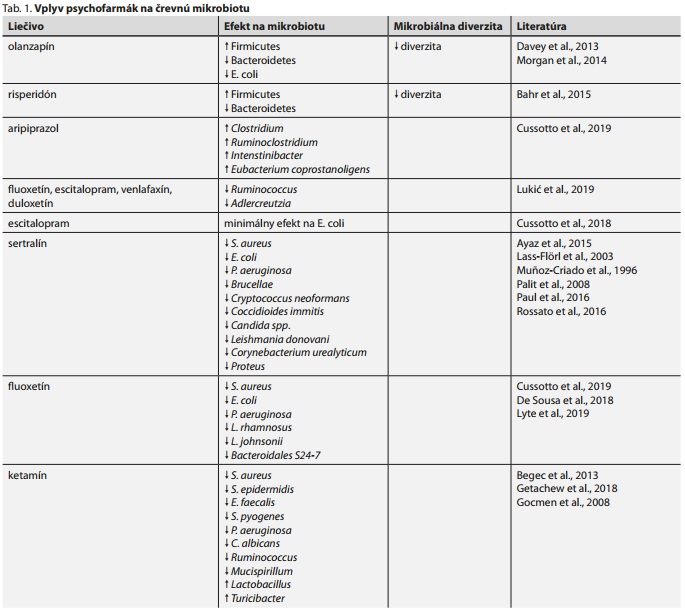
V posledných rokoch sa vedci začali zaoberať zmenami mikrobioty pri užívaní antipsychotík, a to najmä dvoch atypických antipsychotík - olanzapínu a risperidónu. Zistilo sa, že obézni jedinci majú podobné zloženie mikrobioty ako pacienti liečení olanzapínom alebo risperidónom. Podávanie týchto dvoch antipsychotík u hlodavcov viedlo k zníženiu mikrobiálnej diverzity a k zvýšeniu pomeru Firmicutes: Bacteroidetes, podobne ako je tomu u obéznych jedincov (tab. 1). K zaujímavým záverom prišla štúdia, v ktorej bol olanzapín podávaný potkanom. Po aplikácii samotného olanzapínu došlo k očakávanému nárastu hmotnosti, najmä u samičiek. Avšak pri súčasnom podávaní olanzapínu a zmesi viacerých antibiotík (neomycín, polymyxín a metronidazol) došlo opäť k zníženiu pomeru Firmicutes: Bacteroidetes a súčasne k poklesu hmotnosti. V tej istej štúdii došlo k zníženiu hmotnostného prírastku navodeného olanzapínom aj po podaní betahistidínu.31 Iní autori pozorovali, že pri podávaní olanzapínu sterilným myšiam nedochádza k nárastu hmotnosti, na rozdiel od myší po mikrobiálnej kolonizácii, kde sa tento efekt rýchlo objavil.32 Napriek tomu, že tieto štúdie zatiaľ neboli realizované u ľudí, výsledky animálnych štúdií vedú k úvahe o mikroorganizmami podmienenom náraste hmotnosti pri užívaní olanzapínu a o možnej preventabilite tohto nežiaduceho účinku. Iné štúdie poukázali na pozitívny efekt užívania prebiotík v prevencii nárastu hmotnosti u hlodavcov pri súčasnom podávaní olanzapínu, či efekt užívania probiotík na zlepšenie gastrointestinálnych príznakov u pacientov liečených antipsychotikami.33,34 Doposiaľ najpreukázateľnejší efekt na znižovanie hmotnosti u pacientov má stále úprava životného štýlu a fyzická aktivita, avšak neexistuje definovaný štandardný postup pre liečbu antipsychotikami navodeného metabolického syndrómu. Obvykle jeho vznik vedie k výmene podávaného antipsychotika.35 Určité dáta sú dostupné pre liečbu metformínom, topiramátom, sibutramínom, modafinilom a atomoxetínom.29
Podávanie risperidónu myšiam viedlo k zvýšeniu hmotnosti a súčasnému poklesu energetického výdaja, pričom výsledky korelovali so zmenami črevnej mikrobioty. Fekálny transplantát od týchto myší viedol u neliečených myšiek k redukcii bazálneho metabolizmu až o 16 %.36 Chronická liečba risperidónom u detských psychiatrických pacientov viedla k zvýšeniu BMI a signifikantnému nárastu pomeru Firmicutes: Bacteroidetes v porovnaní so zdravými kontrolami.37
Viacero ďalších štúdii preukázalo vplyv antipsychotík na mikrobiotu. Po 4-týždňovom podávaní 20 mg/kg/d aripiprazolu bolo pozorované zvýšenie zastúpenia Clostridium, Ruminoclostridium, Intenstinibacter a Eubacterium coprostanoligens.38 Jedna in vitro štúdia poukázala na inhibíciu rastu E. coli vplyvom olanzapínu, bez vplyvu na rast E. faecalis.32 Výskum realizovaný u pacientov liečených na bipolárnu afektívnu poruchu preukázal zníženie mikrobiálnej diverzity u žien liečených atypickými antipsychotikami, kým u mužov nedošlo k zásadným zmenám diverzity.39 Vyššie uvedená štúdia nereflektovala stravovacie návyky, podstatný faktor ovplyvňujúci zloženie črevnej mikrobioty.
ANTIDEPRESÍVA A ČREVNÁ MIKROBIOTA
Antidepresíva patria v psychiatrii k veľmi často využívanej skupine liekov. Používajú sa najmä na liečbu porúch nálady a úzkostných porúch. Niekoľko štúdií potvrdilo, že užívanie antidepresív je asociované so zmenami črevnej mikrobioty.25 V minulosti sa potvrdil antimikrobiálny efekt tricyklických antidepresív a inhibítorov monoamínoxidázy.40 V súčasnosti sa výskum venuje najmä antidepresívam zo skupiny selektívnych inhibítorov spätného vychytávania sérotonínu (SSRI) a inhibítorov spätného vychytávania sérotonínu a noradrenalínu (SNRI). Napríklad bolo preukázané, že tieto antidepresíva znižujú zastúpenie rodov Ruminococcus a Adlercreutzia (tab. 1). Na druhej strane, súčasné užitie duloxetínu s R. flavefaciens znížilo jeho antidepresívny účinok a je zaujímavé, že došlo k zmene expresie kortikálnych génov zapojených do neuronálnej plasticity.41
Antimikrobiálna aktivita sertralínu sa potvrdila už v 90. rokoch minulého storočia. Zistilo sa, že inhibuje rast S. aureus, E. coli, P. aeruginosa. Potvrdil sa aj efekt proti Brucellae, proti rastu húb a kvasiniek (Cryptococcus neoformans, Coccidioides immitis a Candida spp.), proti Leishmania donovani, ale aj synergický efekt v kombinácii s antibiotikami proti rastu Corynebacterium urealyticum,17,42-47 In vitro použitie fluoxetínu preukázalo antibakteriálny efekt proti štandardným aj multirezistentným kmeňom S. aureus, E. coli, P. aeruginosa a tiež L. rhamnosus.38,48 Naviac sa potvrdil synergický efekt fluoxetínu s gentamicínom a erytromycínom, jeho použitím pravdepodobne dochádza k modulácii antibakteriálnej aktivity antibiotík.48 V inej štúdii bol následkom kontinuálneho podávania fluoxetínu pozorovaný pokles množstva Lactobacillus johnsonii a Bacteroidales S24-7, ktoré sú asociované s reguláciou telesnej hmotnosti,49 In vitro použitie escitalopramu malo minimálny antimikrobiálny efekt na E. coli a žiaden efekt na rast L. rhamnosus, pri venlafaxíne sa nepreukázala žiadna antimikrobiálna aktivita na spomínané bakteriálne kmene.38
V štúdiách s ketamínom sa preukázala jeho účinnosť proti S. aureus, S. epidermidis, E. faecalis, S. pyogenes, P. aeruginosa, ale aj C. albicans,50,51 Po podávaní ketamínu potkanom došlo k nárastu množstva Lactobacillus a Turicibacter a poklesu patogénnych Ruminococcus a Mucispirillum (tab. 1).52 Nízke hladiny Lactobacillus a Turicibacter sú asociované s depresívnou poruchou a po podaní niektorých druhov rodu Lactobacillus dochádza ako v animálnych modeloch, tak aj u ľudí, k zmierneniu príznakov depresie a anxiety.53
U viacerých baktérií sa v animálnych štúdiách potvrdil ich priaznivý vplyv na kognitívne funkcie, pamäť, učenie a správanie, Preukázal sa ich antidepresívny a anxiolytický efekt, Tieto baktérie sa označujú pojmom psychobiotiká, Niektorí autori navrhujú do tohto pojmu zahrnúť aj prebiotiká (najmä fruktooligosacharidy - FOS a galaktooligosacharidy - GOS), ktoré rovnako preukázali priaznivý vplyv na CNS a sú zároveň substrátom pre rast bifidobaktérií a laktobacilov,54 Tiež, v posledných rokoch publikované práce preukázali neuroprotektívny a antidepresívny efekt niektorých antibakteriálnych látok, napríklad ?-laktámových antibiotík, tetracyklínov alebo makrolidov,40 V minulom roku publikovaná animálna štúdia opisuje priaznivý efekt antibiotickej liečby na redukciu hmotnosti a anhedonického správania navodeného vysokotukovou diétou.55
ZÁVER
V súčasnosti môžeme vnímať dôležitosť skúmania črevnej mikrobioty nielen pri telesných poruchách, ale aj v oblasti porúch duševných, Závery štúdií naznačujú jej význam v etiopatogenéze porúch autistického spektra, depresie, úzkostných porúch, porúch príjmu potravy, porúch z okruhu schizofrénie alebo demencií, Rovnako dôležité však bude myslieť aj na možné zmeny mikrobioty pri ich liečbe a pri rozvoji nežiaducich účinkov liečby, pretože črevná mikro-biota môže meniť efektivitu psychofarmák a naopak, psychofarmaká môžu meniť rozmanitosť a pomer kmeňov v črevnej mikrobiote, Spomínané zmeny môžu byť jedným z faktorov vedúcich k vzniku metabolického syndrómu, k nárastu hmotnosti, ale môžu sa podieľať aj na zníženej účinnosti liekov, Uvažuje sa aj o podiele mikrobiálnej dysbiózy na vzniku rezistencie na antidepresíva, avšak výskum v tejto oblasti ešte nebol realizovaný, Priaznivý efekt psychobiotík na zlepšenie nálady, pamäťových schopností a redukciu anxiety tiež poukazuje na možné budúce smerovanie farmakologickej liečby duševných porúch, a to v zmysle ich podávania ako doplnkov výživy alebo súčasného podávania s psychofarmakami, Na základe výsledkov prác venujúcich sa vplyvu rôznych typov diét a jednotlivých zložiek potravy na diverzitu mikrobioty možno uvažovať aj o úprave stravovacích návykov ako jednej z ciest pri zlepšovaní duševného zdravia, Nezanedbateľnou možnosťou pri redukcii symptómov duševnej poruchy sa javí byť aj použitie fekálnej mikrobiálnej transplantácie (FMT), Vzhľadom na sľubné výsledky výskumu črevnej mikrobioty a jej vplyvu na duševné zdravie by podávanie psychobiotík, úprava stravovania alebo použitie FMT mohlo u vybraných pacientov predstavovať formu personalizovanej, alternatívnej alebo adjuvantnej liečby.
LITERATÚRA
- 1. Spotreba humánnych liekov a zdravotníckych pomôcok v SR 2019. NCZI 2020. Dostupné z: http://www.nczisk.sk/Aktuality/Pages/Spotreba-humannych-liekov-a-zdravotnickych-pomocok-v-SR-2019.aspx.
- 2. Tomova A, Bukovsky I, Rembert E et al. The Effects of Vegetarian and Vegan Diets on Gut Microbiota. Front Nutr 2019; 6: 47.
- 3. Gagliardi A, Totino V, Cacciotti F et al. Rebuilding the Gut Microbiota Ecosystem. Int J Environ Res Public Health 2018; 15 (8).
- 4. Pascale A, Marchesi N, Govoni S, Barbieri A. Targeting the microbiota in pharmacology of psychiatric disorders. Pharmacol Res 2020; 157: 104856.
- 5. Roubalová R, Procházková P, Papežová H, Smitka K, Bilej M, Tlaskalová-Hogenová H. Anorexia nervosa: Gut microbiota-immune-brain interactions. Clin Nutr 2020; 39 (3): 676-684.
- 6. Lloyd-Price J, Abu-Ali G, Huttenhower C. The healthy human microbiome. Genome Med 2016; 8 (1): 51.
- 7. Sender R, Fuchs S, Milo R. Revised Estimates for the Number of Human and Bacteria Cells in the Body. PLoS Biol 2016; 14 (8): e1002533.
- 8. Kim S, Jazwinski SM. The Gut Microbiota and Healthy Aging: A Mini-Review. Gerontology 2018; 64 (6): 513-520.
- 9. Cox LM, Abou-El-Hassan H, Maghzi AH, Vincentini J, Weiner HL. The sex-specific interaction of the microbiome in neurodegenerative diseases. Brain Res 2019; 1724: 146385.
- 10. O´Hara AM, Shanahan F. The gut flora as a forgotten organ. EMBO Rep 2006; 7 (7): 688-693.
- 11. Rinninella E, Raoul P, Cintoni M et al. What is the Healthy Gut Microbiota Composition? A Changing Ecosystem across Age, Environment, Diet, and Diseases. Microorganisms 2019; 7 (1).
- 12. Ringel Y, Maharshak N, Ringel-Kulka T, Wolber EA, Sartor RB, Carroll IM. High throughput sequencing reveals distinct microbial populations within the mucosal and luminal niches in healthy individuals. Gut Microbes 2015; 6 (3): 173-181.
- 13. Mottawea W, Butcher J, Li J et al. The mucosal-luminal interface: an ideal sample to study the mucosa-associated microbiota and the intestinal microbial biogeography. Pediatr Res 2019; 85 (6): 895-903.
- 14. Arumugam M, Raes J, Pelletier E et al. Enterotypes of the human gut microbiome. Nature 2011; 473 (7346): 174-180.
- 15. Yatsunenko T, Rey FE, Manary MJ et al Human gut microbiome viewed across age and geography Nature 2012; 486 (7402): 222-227.
- 16. Jaggar M, Rea K, Spichak S, Dinan TG, Cryan JF You´ve got male: Sex and the microbiota-gut-brain axis across the lifespan Front Neuroendocrinol 2020; 56: 100815
- 17. Cussotto S, Clarke G, Dinan TG, Cryan JF Psychotropics and the Microbiome: a Chamber of Secrets... Psychopharmacology (Berl) 2019; 236 (5): 14111432
- 18. Hyland NP, Cryan JF Microbe-host interactions: Influence of the gut microbiota on the enteric nervous system Dev Biol 2016; 417 (2): 182-187
- 19. Mayer EA Gut feelings: the emerging biology of gut-brain communication Nat Rev Neurosci 2011; 12 (8): 453-466
- 20. Tomova A, Pivovarciova A, Babiska K, Mravec B Os črevo-mozog: význam interakcií medzi črevnou mikrobiotou a mozgom za patologických a fyziologických situácií Ceskoslovenska fyziologie 2015; 64 (1): 23-34
- 21. Schimpfle L Gut microbiota influence on behavior Diploma Thesis Comenius University in Bratislava; 2018: 58
- 22. Cussotto S, Sandhu KV, Dinan TG, Cryan JF The Neuroendocrinology of the Microbiota-Gut-Brain Axis: A Behavioural Perspective Front Neuroendocrinol 2018; 51: 80-101
- 23. Maier L, Pruteanu M, Kuhn M et al Extensive impact of non-antibiotic drugs on human gut bacteria Nature 2018; 555 (7698): 623-628
- 24. Stefano GB, Ptacek R, Raboch J, Kream RM Microbiome: A Potential Component in the Origin of Mental Disorders Med Sci Monit 2017; 23: 3039-3043
- 25. Ticinesi A, Milani C, Lauretani F et al Gut microbiota composition is associated with polypharmacy in elderly hospitalized patients Sci Rep 2017; 7 (1): 11102
- 26. Alexander JL, Wilson ID, Teare J, Marchesi JR, Nicholson JK, Kinross JM Gut microbiota modulation of chemotherapy efficacy and toxicity Nat Rev Gastroenterol Hepatol 2017; 14 (6): 356-365
- 27. Selwyn FP, Cui JY, Klaassen CD RNA-Seq Quantification of Hepatic Drug Processing Genes in Germ-Free Mice Drug Metab Dispos 2015; 43 (10): 1572-1580
- 28. Takeno S, Sakai T Involvement of the intestinal microflora in nitrazepam-induced teratogenicity in rats and its relationship to nitroreduction Teratology 1991; 44 (2): 209-214
- 29. Pečeňák J, Kořínková V et al Psychofarmakológia Prvé vydanie Wolters Kluwer s r o 2016: 672
- 30. Chen A, Park TY, Li KJ, DeLisi LE Antipsychotics and the microbiota Curr Opin Psychiatry 2020; 33 (3): 225-230
- 31. Davey KJ, Cotter PD, O´Sullivan O et al Antipsychotics and the gut microbi ome: olanzapine-induced metabolic dysfunction is attenuated by antibiotic administration in the rat Transl Psychiatry 2013; 3: e309
- 32. Morgan AP, Crowley JJ, Nonneman RJ et al The antipsychotic olanzapine interacts with the gut microbiome to cause weight gain in mouse PLoS One 2014; 9 (12): e115225
- 33. Kao AC, Spitzer S, Anthony DC, Lennox B, Burnet PWJ Prebiotic attenuation of olanzapine-induced weight gain in rats: analysis of central and peripheral biomarkers and gut microbiota Transl Psychiatry 2018; 8 (1): 66
- 34. Dickerson FB, Stallings C, Origoni A et al Effect of probiotic supplementation on schizophrenia symptoms and association with gastrointestinal functioning: a randomized, placebo-controlled trial Prim Care Companion CNS Disord 2014; 16 (1)
- 35. Lieberman JA, Stroup TS, McEvoy JP et al Effectiveness of antipsychotic drugs in patients with chronic schizophrenia N Engl J Med 2005; 353 (12): 12091223
- 36. Bahr SM, Weidemann BJ, Castro AN et al Risperidone-induced weight gain is mediated through shifts in the gut microbiome and suppression of energy expenditure EBioMedicine 2015; 2 (11): 1725-1734
- 37. Bahr SM, Tyler BC, Wooldridge N et al Use of the second-generation antipsychotic, risperidone, and secondary weight gain are associated with an altered gut microbiota in children Transl Psychiatry 2015; 5: e652
- 38. Cussotto S, Strain CR, Fouhy F et al Differential effects of psychotropic drugs on microbiome composition and gastrointestinal function Psychopharmacology (Berl) 2019; 236 (5): 16711685
- 39. Flowers SA, Evans SJ, Ward KM, McInnis MG, Ellingrod VL Interaction Between Atypical Antipsychotics and the Gut Microbiome in a Bipolar Disease Cohort Pharmacotherapy 2017; 37 (3): 261-267
- 40. Macedo D, Filho AJMC, Soares de Sousa CN et al Antidepressants, antimicrobials or both? Gut microbiota dysbiosis in depression and possible implications of the antimicrobial effects of antidepressant drugs for antidepressant effectiveness J Affect Disord 2017; 208: 22-32
- 41. Lukic I, Getselter D, Ziv O et al. Antidepressants affect gut microbiota and Ruminococcus flavefaciens is able to abolish their effects on depressive-like behavior. Transl Psychiatry 2019; 9 (1): 133.
- 42. Ayaz M, Subhan F, Ahmed J et al. Sertraline enhances the activity of antimicrobial agents against pathogens of clinical relevance. J Biol Res (Thessalon) 2015; 22 (1): 4.
- 43. Rossato L, Loreto É, Zanette RA, Chassot F, Santurio JM, Alves SH. In vitro synergistic effects of chlorpromazine and sertraline in combination with amphotericin B against Cryptococcus neoformans var. grubii. Folia Microbiol (Praha) 2016; 61 (5): 399-403.
- 44. Palit P, Ali N. Oral therapy with sertraline, a selective serotonin reuptake inhibitor, shows activity against Leishma-nia donovani. J Antimicrob Chemother 2008; 61 (5): 1120-1124.
- 45. Paul S, Mortimer RB, Mitchell M. Sertraline demonstrates fungicidal activity. Mycology 2016; 7 (3): 99-101.
- 46. Lass-Florl C, Ledochowski M, Fuchs D et al. Interaction of sertraline with Candida species selectively attenuates fungal virulence in vitro. FEMS Immunol Med Microbiol 2003; 35 (1): 11-15.
- 47. Muňoz-Criado S, Muňoz-Bellido JL, García-Rodríguez JA. In vitro activity of nonsteroidal anti-inflammatory agents, phenotiazines, and antidepressants against Brucella species. Eur J Clin Microbiol Infect Dis 1996; 15 (5): 418-420.
- 48. Karine de Sousa A, Rocha JE, Goncalves de Souza T, Sampaio de Freitas T, Ribeiro-Filho J, Melo Coutinho HD. New roles of fluoxetine in pharmacology: Antibacterial effect and modulation of antibiotic activity. Microb Pathog 2018; 123: 368-371.
- 49. Lyte M, Daniels KM, Schmitz-Esser S. Fluoxetine-induced alteration of murine gut microbial community structure: evidence for a microbial endocrinology-based mechanism of action responsible for fluoxetine-induced side effects. PeerJ 2019; 7: e6199.
- 50. Gocmen S, Buyukkocak U, Caglayan O. In vitro investigation of the antibacterial effect of ketamine. Ups J Med Sci 2008; 113 (1): 39-46.
- 51. Begec Z, Yucel A, Yakupogullari Y et al. The antimicrobial effects of ketamine combined with propofol: An in vitro study. Braz J Anesthesiol 2013; 63 (6): 461-465.
- 52. Getachew B, Aubee JI, Schottenfeld RS, Csoka AB, Thompson KM, Tizabi Y. Ketamine interactions with gut-microbiota in rats: relevance to its antidepressant and anti-inflammatory properties. BMC Microbiol 2018; 18 (1): 222.
- 53. Chao L, Liu C, Sutthawongwadee S et al. Effects of Probiotics on Depressive or Anxiety Variables in Healthy Participants Under Stress Conditions or With a Depressive or Anxiety Diagnosis: A Meta-Analysis of Randomized Controlled Trials. Front Neurol 2020; 11: 421.
- 54. Bermúdez-Humarán LG, Salinas E, Ortiz GG, Ramirez-Jirano LJ, Morales JA, Bitzer-Quintero OK. From Probiotics to Psychobiotics: Live Beneficial Bacteria Which Act on the Brain-Gut Axis. Nutrients 2019; 11 (4).
- 55. Hassan AM, Mancano G, Kashofer K et al. Anhedonia induced by high-fat diet in mice depends on gut microbiota and leptin. Nutr Neurosci 2020: 1-14.





