Česká a slovenská psychiatrie

Časopis
Psychiatrické společnosti ČLS JEP
a Psychiatrickej spoločnosti SLS
souborný článek / review article
HOMOCYSTEIN V ETIOPATOGENEZI DEPRESIVNÍ PORUCHY A ALZHEIMEROVY NEMOCI
HOMOCYSTEINE IN THE ETIOPATHOGENESIS OF THE DEPRESSIVE DISORDER AND THE ALZHEIMER DISEASE
Eva Kitzlerová, Zdeněk Fišar, Jiří Raboch
Psychiatrická klinika 1. LF UK a VFN, Praha
Podpořeno Výzkumným záměrem VZMSM 0021620849, grantem MZ ČR - RVO VFN64165 a projektem PRVOUK-P26/LF1/4 (Univerzita Karlova v Praze).
SOUHRN
Kitzlerová E, Fišar Z, Raboch J. Homocystein v etiopatogenezi depresivní poruchy a Alzheimerovy nemoci
Některá neurodegenerativní onemocnění, jako jsou Alzheimerova choroba a deprese, mohou být spojena se zvýšenými koncentracemi homocysteinu. Homocystein může podporovat glutamátovou excitotoxicitu nadměrnou stimulací N-methyl-D-aspartátových receptorů, poškození DNA a aktivaci apoptózy Právě těmito mechanismy může pak přispívat k neuro degeneraci u chorob vyššího věku, u chorob spojených se stresem aj. Homocysteinová hypotéza depresivní poruchy předpokládá, že genetické faktory a faktory životního prostředí zvyšují plazmatické koncentrace homocysteinu, které pak způsobují cévní onemocnění mozku a změny v neurotransmiterových systémech, což vede k rozvoji depresivní poruchy. Depresivní symptomy zhoršují již existující morbiditu u 50 % pacientů s Alzheimerovou nemocí. Na Psychiatrické klinice 1. LF UK a VFN Praha probíhal výzkum s cílem hodnocení homocysteinových koncentrací u depresivní poruchy a Alzheimerovy choroby. Výsledky budou publikovány v blízké době.
Klíčová slova: homocystein, depresivní porucha, Alzheimerova choroba
SUMMARY
Kitzlerová E, Fišar Z, Raboch J. Homocysteine in the etiopathogenesis of the depressive disorder and the Alzheimer disease
Several disorders maybe associated with increased concentrations of total homocysteine, including neurodegenerative and psychiatric disorders, such as Alzheimer's disease (AD), depression. Homo cysteine can promote glutamate ex-citotoxicity through overstimulation of N-methyl-D-aspartate receptors, DNA damage and activation of apoptosis. Thus, homocysteine can contribute to neuronal degeneration in age-related or stress-related neuropsychiatric disorders and etc. The homocysteine hypothesis of depression presumes that genetic and environmental factors elevate homocysteine levels, which cause vascular disease of the brain and/or neurotransmitter alterations, which in turn cause depression. Depressive symptoms exacerbate pre-existing patient morbidity in about 50% of AD patients. Thus, there are important reasons for research of homocysteine concentrations in AD, depression and AD with depression, which conducted at Psychiatric Department of General University Hospital and 1st Medical School, Charles University in Prague. Results of our research will be published soon.
Key words: homocystein, depression, Alzheimer disease
ÚVOD
Depresivní porucha a Alzheimerova nemoc (AN) patří mezi hlavní neuropsychiatrická onemocnění. Depresivní symptomy jsou častou psychiatrickou komplikací AN vyskytující se až u 50 % těchto pacientů.1,2 Nebyly však potvrzeny významné rozdíly v prevalenci deprese mezi kontrolními osobami a osobami s AN.3 Depresivní symptomy ve stáří jsou spíše symptomy skutečné depresivní poruchy nikoli prodromy AN.4 Nicméně u osob s dřívější historií depresivní poruchy byla v pozdějším věku diagnostikována AN s větší pravděpodobností.5 Nepříznivé účinky deprese doprovázející AN mohou být vysvětleny známými účinky depresivní poruchy na zvýšenou neurozánětlivou zátěž vedoucí k progresi neurodegenerativních procesů.6 Změny v aktivitách stejných periferních i centrálních signálních cest mohou na neurochemické úrovni vysvětlit současný výskyt depresivních symptomů u AN i u jiných neurodegenerativních onemocnění.
Poruchy nálady jsou častým onemocněním s opakujícím se nebo chronickým průběhem. Patofyziologie poruch nálady není dostatečně známa. Náchylnost k onemocnění je dána jak genetickými faktory, tak individuální citlivostí na stresory a předchozí historií. Léčba antidepresivy stabilizátory nálady, elektrokonvulzivní terapie a psychoterapie jsou obvykle účinné, avšak část pacientů na léčbu neodpovídá dostatečně, jeví známky tzv. farmakorezistence. V dnešní době nejsou známy dostatečně citlivé a selektivní genetické, biochemické, fyziologické, neuroendokrinní či jiné biologické testy, které by umožnily diagnostikovat depresivní poruchy a jejich podtypy, nebo které by byly schopny predikovat úspěšnost odezvy na farmakoterapii. Cílem výzkumu v této oblasti je proto nalezení biologických markerů měřitelných v periferní krvi a specifických pro poruchy nálady nebo pro antidepresivní či stabilizující účinky léčiv.7
Kromě malého procenta geneticky podmíněných případů není příčina AN známa. Mezi známé hypotézy vzniku AN provázené neurodegenerací a kognitivním postižením patří hypotéza cholinergní (snížená syntéza acetylcholinu), amyloidová (abnormální akumulace amyloidu-β) a tau (patologická agregace tau proteinu). Pozornost je však věnována řadě dalších faktorů, které mohou být zahrnuty v etiologii AN, především mechanismům vedoucím k poškození neuroplasticity a neurogeneze,8 jako jsou mitochondriální dysfunkce9 a další.
Společné patofyziologické mechanismy pro depresivní poruchu a AN zahrnují zvýšenou aktivitu osy hypotalamus - hypofýza - kůra nadledvin, chronické zánětlivé procesy, zvýšený oxidační a nitrosační stres, narušenou neuroplasticitu a neurogenezi.10 Biologicky aktivními molekulami studovanými jak při depresivní poruše, tak při AN jsou proto glukokortikoidy, prozánětlivé cytokiny transkripční faktor aktivovaný v odezvě na zvýšení hladin cAMP (CREB), mozkový neurotrofní faktor (BDNF), glykogensyntázakináza-3 (GSK-3) a další.6,11 Jedním z biochemických markerů, zjistitelným z periferní krve a podílejícím se na patofyziologii neurodegenerativních poruch (jako jsou poruchy nálady, Alzheimerova nemoc aj.), je homocystein.
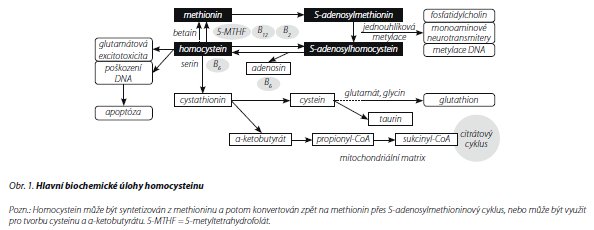
HOMOCYSTEIN - OBECNÁ FAKTA
Už objevitel aminokyselin Vincent du Vigneaud označil homocystein v roce 1932 za toxický. Homocystein vzniká z esenciální aminokyseliny methioninu demetylací a vyskytuje se v živých buňkách všech vyšších organismů. Byl nalezen také v rostlinných a bakteriálních buňkách jako aminokyselina, která stojí na křižovatce přeměn aminokyselin obsahujících ve své molekule síru. 12
Homocystein je syntetizován z methioninu přes S-adenosylmethionin, který přenáší metylovou skupinu k akceptorové molekule v řadě důležitých reakcí, jako je metylace DNA nebo syntéza monoaminových neurotransmiterů a fosfolipidů13 (obr. 1). Homocystein je konvertován zpět na methionin.14 Metabolismus homocysteinu závisí na mnoha B vitaminech, včetně B9 (folát), B12 (kobalamin), B6 (pyridoxin) a B2 (riboflavin). Nedostatek těchto vitaminů může vést k vysokým koncentracím homocysteinu.15,16 Homocystein je jak markerem nedostatku folátu nebo B12,17 tak příčinou mnoha nežádoucích účinků na neurony18 Ke zvýšeným koncentracím homocysteinu vedou změny v jeho metabolismu, nedostatečný přísun vitaminů B, narušené renální funkce, zvýšený věk, mužské pohlaví, nadměrný příjem alkoholu, nedostatek fyzické aktivity a vysoká spotřeba kávy.14, 19
Biologický význam homocysteinu určuje jeho účast v základních životních procesech, a to v hospodaření s kyslíkem (buněčné dýchání), v řízené tvorbě energie, jejím ukládání a využívání, dále v syntéze a recyklaci některých klíčových metabolitů a v rozmnožování buněk. Genetické naprogramování a regulace těchto procesů zpětnými vazbami jsou ukázkou udržování stálosti vnitřního prostředí. Velká skupina zdánlivě nesourodých nemocí má příčinu v nitrobuněčné metabolické poruše, při které vzniká v nadměrném množství toxická látka homocystein a způsobuje v podstatě otravu organismu.
Po roce 1962 přiznali lékaři této aminokyselině účast na vzniku vzácně se vyskytujícího vrozeného metabolického onemocnění homocystinurie. Vyšší hladina homocysteinu je spojena s rychlejším rozvojem tepenné aterosklerózy a jejích tromboembolických komplikací a byla zformulována tzv. homocysteinová teorie aterosklerózy.12 Podle současných znalostí zapříčiňuje kromě kardiovaskulárních onemocnění přítomnost homocysteinu také četné nádory, předčasné stárnutí, zánětlivá revmatická onemocnění kloubů, předčasné porody a některé vrozené vývojové vady nervového systému.20,21 Homocystein je neurotoxický takže se podílí na poklesu mentální kapacity jedince a vývoji demence. Řada studií dokládá jeho roli v etiopatogenezi autismu, kognitivních poruch, schizofrenie, deprese, vaskulární demence a AN.22,23,24,25
Pokud jsou všechny procesy "homocysteinového cyklu" v rovnováze, hladina homocysteinu v krvi se udržuje v rozmezí 10 μmol/1, u dospělých by měla být nižší než 15 μmol/1. Jeho normální hladina s věkem stoupá. Podle statistik se zvýšená hladina homocysteinu vyskytuje u každého pátého člověka a je podmíněna geneticky, hormonálně nebo toxickými vlivy, ale nejzásadnější vliv mají stravovací návyky, které jsou založeny na konzumaci průmyslově vyráběných potravin (http://www.karelerben.cz/homocystein-objev27).
Vitaminy skupiny B (pyridoxin - B6, kyselina listová, folát - B9 a kobalamin - B12) jsou kofaktory nebo substráty enzymů při metabolických přeměnách homocysteinu a významným způsobem ovlivňují metabolismus homocysteinu ve tkáních a v krvi.20,26 Mnoho autorů se domnívá, že právě nedostatek těchto vitaminů ve výživě vede ke zvýšenému výskytu onemocnění vyvolaných nadměrným hromaděním homocysteinu, tzv. hyperhomocysteinémii. O tyto vitaminy se ochuzujeme díky nezdravé stravě především díky větší spotřebě masa a masných výrobků, mléka a mléčných výrobků, a menší spotřebě syrové a čerstvé zeleniny. Cílená suplementace vitaminy skupiny B by pak mohla být využívána i pro prevenci některých uváděných nemocí.24,26 V poslední době se však podařilo rozpoznat, že nezáleží jen na množství vitaminů, které člověk pozře s potravou nebo spolkne v tabletách. Ukázalo se, že o hladině homocysteinu v krvi rozhoduje množství vitaminů, které projdou stěnou zažívacího traktu do krve a z ní do buněk. Spolehlivý přívod tří vitaminů B do buněk dokáže zabránit poškozování enzymů, nadměrnému vzniku volných radikálů s poškozováním mitochondrií a vazivových vláken, nedovolí zvyšování cholesterolu a zastaví tak rozvoj dalších poškození organismu, která vyúsťují v pestrý seznam nemocí s tímto společným původem (27).
HOMOCYSTEIN JAKO RIZIKOVÝ FAKTOR DEPRESIVNÍ PORUCHY
V etiopatogenezi depresivní poruchy je v souvislosti s homocysteinem nejčastěji diskutována deficience kyseliny listové (folátu). Předchozí studie naznačují, že folátová deficience se může objevit u více než třetiny pacientů trpících těžkou depresí.28,29,30 Ačkoliv může být folátová deficience důsledkem zhoršeného stravování při depresivní poruše, existují důkazy z kontrolovaných studií,28,30,31 které naznačují, že ať se jedná o deficienci primární, či sekundární, substituce folátu v každém případě urychlí úzdravu, pravděpodobně mechanismem metylace.32 Celková koncentrace homocysteinu v plazmě se považuje za senzitivnější marker měření deficience folátu a vitaminu B12 než vlastní folát, u mnohých pacientů obtížně měřitelný v erytrocytech, jehož koncentrace korelují signifikantně se stoupajícími koncentracemi homocysteinu.
Některé studie zabývající se poruchami nálady naznačují vztah mezi deficienci folátu a narušeným metabolismem serotoninu, dopaminu a noradrenalinu. Ve studii Trimble z roku 1996 mělo 52% depresivních nemocných s vysokými koncentracemi homocysteinu signifikantně snížené koncentrace folátu v plazmě, v červených krvinkách a v likvoru, dále S-adenosylmethioninu a všech tří monoaminových metabolitů v likvoru.33 Již některé dřívější studie naznačily vztah mezi folátem, S-adeno-sylmethioninem a metabolismem monoaminů pravděpodobně přes tetrahydropterin, kofaktor nutný k syntéze monoaminových neurotransmiterů.34 Jak experimentální, tak i klinická deficience folátu byla spojena s narušeným metabolismem serotoninu.38,39 Existují důkazy o tom, že podání S-adenosylmethioninu je spojeno se zvýšeným obratem serotoninu, dopaminu a noradrenalinu.37 Ačkoliv jsou jasné evidence o vztahu mezi folátem a biopterinovým metabolismem, což může vést k oslabení metabolismu monoaminů při folátové deficienci, přesný mechanismus není znám.13 Jedním možným mechanismem je, že metyltetrahydrofolát může hrát neuromodulační úlohu na presynaptických místech vazbou na glutamátové receptory40 a aktivace presynaptických glutamátových receptorů je zapojena do uvolňování biogenních aminů.41
S-adenosylmethionin, metabolit v homocysteinové metabolické cestě, vykazuje antidepresivní efekt, který je větší než placebo a srovnatelný s tricyklickými antidepresivy.37,51 Tuto vlastnost S-adenosylmethioninu je třeba mít na paměti při léčbě depresivní poruchy, stejně jako suplementaci folátem.30 Bylo zjištěno, že depresivní pacienti s nízkou koncentrací folátu nebo zvýšenými koncentracemi homocysteinu vykazují signifikantně menší léčebnou odpověď na antidepresiva.42,43 Důležitá je detekce těchto pacientů, protože mohou profitovat ze suplementace vitaminy B v kombinaci s psychofarmakologickou medikací, což bylo potvrzeno v placebem kontrolovaných studiích s kyselinou listovou31 a methylfolátem.30
I v pozdějším věku se prevalence deprese zvyšuje s celkovými plazmatickými koncentracemi homocysteinu.13 Etiologie depresivní poruchy je v pozdějším věku komplexní, současné evidence naznačují, že významnou roli hrají kardiovaskulární rizikové faktory.44 Narušený metabolismus homocysteinu se vyskytuje u 15-30 % pacientů s předčasně vzniklými kardiovaskulárními chorobami47 a mírná hyperhomocysteinémie je nezávislý, rizikový faktor pro rozvoj kardiovaskulárních chorob. Výsledky recentní metaanalýzy prospektivních studií naznačují, že snížení plazmatických koncentrací homocysteinu o 25 % (o 3 (μmol/1) snižuje riziko rozvoje ischemické choroby srdeční a onemocnění srdce o 11 % a riziko cévních mozkových příhod o 19 %.46
Zvýšené koncentrace homocysteinu jsou vazotoxické a neurotoxické (způsobují deficienci neurotransmiterů) a genetická dispozice určitého typu populace zvyšuje riziko vzniku vaskulárních chorob v mozku, které jsou často následovány rozvojem depresivní poruchy.49,50 Cévní mozkové příhody jsou obvykle spojeny s kardiovaskulárními onemocněními a deprese je symptom a zároveň rizikový faktor pro rozvoj kardiovaskulárních chorob.48 Snížením hladin homocysteinu suplementací vitaminy B dochází ke zmírnění depresivních symptomů u těchto nemocných.45
HOMOCYSTEIN JAKO RIZIKOVÝ FAKTOR ALZHEIMEROVY NEMOCI
V současné době existují důkazy o tom, že homocystein představuje samostatný, nezávislý rizikový faktor pro vznik atrofie mozku, kognitivních poruch, vaskulární demence a Alzheimerovy nemoci (AN),24 ale výsledky studií nejsou jednoznačné. Studie Morrisové z roku 2003 potvrdila, že vysoké koncentrace plazmatického homocysteinu jsou prokazatelným, nezávislým rizikovým faktorem pro vznik cévních mozkových příhod, se kterými se často (ve 25%) vyskytuje AN. Mnoho studií dokládá, že v průběhu stárnutí se snižují hladiny vitaminů B12 a folátu a zvyšuje se hladina homocysteinu.24,25, 53 Chen et al.54 zjistili, že ve skupině 83 pacientů s mírnou AN byla vyšší koncentrace homocysteinu nalezena pouze u těch nemocných, kteří trpěli depresí. Morillas56 nalezl vyšší koncentraci homocysteinu u pacientů s mírnou AN v porovnání s kontrolami bez AN. Tu et al.57 vyšetřili v čínské studii 92 pacientů s AN a zjistili, že koncentrace homocysteinu se neliší u pacientů s AN v porovnání s věkově odpovídajícími kontrolami, avšak vyšší koncentrace homocysteinu byla spojena s rychlejším poklesem skóre kognitivních testů a omezením abstraktního myšlení. Metaanalýza devíti studií u celkem 631 pacientů s AN a 703 kontrol potvrdila vyšší hladinu homocysteinu u pacientů s AN a tento nález byl spojen s nižšími koncentracemi trojice vitaminů B.55 Ve studii Vogiatzouglou et al.58 sledovali po dobu pěti let koncentrace vitaminů B v organismu stárnoucí populace a zjistili, že snížení vitaminu B12 je spojeno s rychlejším zmenšováním objemu mozku. U geriatrických psychiatrických pacientů, u kterých byla zjištěna deficience vitaminu B12 a hyperhomocysteinémie, se deficience vitaminu B12 považovala za důsledek jejich zhoršené sebepéče, zanedbávání výživy, toto však není jednoznačné.59 Řada autorů doporučuje podávat vitaminy B (B6, B9, B12) jako prevenci vzniku demence a AN a zpomalení neurodegenerativních změn v průběhu stárnutí.24,25,58
U nemocných s AN byla zobrazovacími metodami (MRI) zjištěna atrofie mediotemporálního laloku a zmenšení šířky hipokampu se vzrůstajícími koncentracemi homocysteinu, což je považováno za hlavní příčinu poruch paměti. Homocystein je excitotoxický ke kortikálním neuronům, což vede k cholinergnímu deficitu typickému pro AN.60 McCaddon et al.59 prohlásili, že nadměrný oxidativní stres může vést k vyčerpání zásob glutathionu, jehož nízké koncentrace jsou spojeny s progresí AN a neschopností kompenzovat potenciální oxidativní poškození způsobené folátovou deplecí nebo hyperhomocysteinémií.18
Nová studie Čita et al. z roku 201062 se zabývala měřením celkového plazmatického homocysteinu, pak i hlavních markerů oxidativního stresu měřených v krvi u pacientů s AN, užívajících vitamin B12 a folát, a věkově adekvátních kontrol. Byly též měřeny hladiny vitaminu B12 a folátu k ověření jejich vlivu na koncentraci homocysteinu. Byl prokázán vliv hyperhomocysteinémie na strukturální a funkční změny mozkových cév (vazotoxicita homocysteinu) a neuronů (neurotoxicita homocysteinu) s tím, že oxidativní stres hraje hlavní roli během těchto změn.63,64 Výsledky prokázaly zvýšení koncentrací markerů oxidativního stresu (hypoxanthinu, xanthinu, homocysteinu a cysteinu) v obou skupinách pacientů jak s AN, tak v kontrolní skupině. Výsledky naznačují, že zvýšení těchto markerů je závislé na věku, stejně jako zvýšení homocysteinu ("age dependent"), nikoliv na druhu nemoci ("specific disease"). Normální hodnoty homocysteinu se pohybují mezi 5 a 15 μmol/1, koncentrace homocysteinu jsou do 40 let věku poměrně stabilní, pak začnou prudce stoupat, především po 70 letech věku.65,66,67 V této studii byly koncentrace homocysteinu závislé na věku, bez signifikantního vlivu vitaminu B12 a folátu. Vzhledem k tomu, že koncentrace homocysteinu a markerů oxidativního stresu byly proměnnou vyššího věku, nezdá se, že by homocystein sám o sobě mohl být považován za marker specifický pro screening kognitivního deficitu nebo AN. Toto potvrzuje i studie Nilsona et al.,68 dle které jsou zvýšené koncentrace celkového homocysteinu přítomny zároveň i u vaskulárních chorob, resp. nejsou vztaženy ke specifickým gerontopsychiatrickým diagnózám.
Studie Fortiho et al.69 se zabývala tím, zda jsou zvýšené koncentrace homocysteinu prediktorem rozvoje depresivní poruchy v populaci starší 65 let. Pouze u žen byly nejvyšší koncentrace homocysteinu spojeny se vznikem deprese. Hlavní kauzální roli v rozvoji deprese pozdního věku hraje vaskulární poškození a homocystein, který je rizikovým faktorem rozvoje aterosklerózy.70,71
ZÁVĚR
Homocysteinová hypotéza depresivní poruchy předpokládá, že genetické a environmentální faktory zvyšují plazmatické koncentrace homocysteinu, které pak způsobují cévní onemocnění mozku a změny v neurotransmiterových systémech, což vede k rozvoji depresivní poruchy72 Těžká depresivní fáze u pacientů s mírným stupněm Alzheimerovy demence je spojena s vyššími plazmatickými koncentracemi homocysteinu ve srovnání s pacienty bez deprese.54 Zvýšené koncentrace homocysteinu se považují za jeden z rizikových faktorů vedoucích k narušení kognitivních funkcí ve vyšším věku a k rozvoji Alzheimerovy demence.25,73 Snížení těchto koncentrací může vést ke zpomalení progrese AN.24,74,75,76
Na Psychiatrické klinice 1. LF K a VFN v Praze probíhá výzkumný záměr, v rámci kterého jsme hodnotili plazmatické koncentrace homocysteinu v periferní krvi u několika skupin pacientů - pacientů trpících AN, pacientů trpících AN s komorbidní depresí, u depresivních pacientů a u zdravých kontrol. Cílem studie bylo jednak zjištění korelace mezi plazmatickými koncentracemi homocysteinu, závažností depresivity a stupněm narušení kognitivních funkcí u pacientů s AN a jednak zjištění aditivního efektu AN a deprese na plazmatické koncentrace homocysteinu. Výsledky našeho výzkumu budou publikovány v blízké době.
LITERATURA
- 1. Migliorelli R, Tesón A, Sabe L, Petracchi M, Leiguarda R, Starkstein SE. Prevalence and correlates of dysthymia and major depression among patients with Alzheimer's disease. Am J Psychiatry 1995; 152 (1): 37-44.
- 2. Lyketsos CG, Olin J. Depression in Alzheimer's disease: overview and treatment. Biol Psychiatry 2002; 52 (3): 243-252.
- 3. Heun R, Schoepf D, Potluri R, Natalwala A. Alzheimer's disease and co-morbidity: increased prevalence and possible risk factors of excess mortality in a naturalistic 7-year follow-up. Eur Psychiatry 2013; 28 (1): 40-48.
- 4. Mossaheb N, Zehetmayer S, Jungwirth S, Weissgram S, Rainer M, Tragl KH, Fischer P. Are specific symptoms of depression predictive of Alzheimer's dementia? J Clin Psychiatry 2012; 73 (7): 1009-1015.
- 5. Ownby RL, Crocco E, Acevedo A, John V, Loewenstein D. Depression and risk for Alzheimer disease: systematic review, meta-analysis, and metaregression analysis. Arch Gen Psychiatry 2006; 63 (5): 530-538.
- 6. Maes M, Kubera M, Obuchowiczwa E, Goehler L, Brzeszcz J. Depression's multiple comorbidities explained by (neuro)inflammatory and oxidative & nitrosative stress pathways. Neuro Endocrinol Lett 2011; 32 (1): 7-24.
- 7. Fišar Z, Raboch J. Depression, antidepressants, and peripheral blood components. Neuro Endocrinol Lett 2008; 29 (1): 17-28.
- 8. Lilja AM, Röjdner J, Mustafiz T, Thome CM, Storelli E, Gonzalez D, Unger-Lithner C, Greig NH, Nordberg A, Marutle A. Age-dependent neuroplasticity mechanisms in Alzheimer Tg2576 Mice Following Modulation of Brain Amyloid-β Levels. PLoS One 2013; 8 (3): e58752.
- 9. Chaturvedi RK, Flint Beal M. Mitochondrial Diseases of the Brain. Free Radic Biol Med 2013 Apr 6. doi: pii: S0891-5849(13)00123-8. 10.1016/j.freeradbiomed2013.03.018. [Epub ahead of print]
- 10. Fišar Z, Hroudová J, Raboch J. Neurotransmission in Mood Disorders. In: Clinical, Research and Treatment Approaches to Affective Disorders, Mario Francisco Juruena (Ed.), InTech, Rijeka, Croatia, 2012: 191-234. Available from: http://www.intechopen.com/articles/show/title/neurotransmission-in-mood-disorders.
- 11. Caraci F, Copani A, Nicoletti F, Drago F. Depression and Alzheimer's disease: neurobiological links and common pharmacological targets. Eur J Pharmacol 2010; 626 (1): 64-71.
- 12. Stranečka A: Homocystein jako rizikový faktor v psychiatrii. Psychiatrie 2011; 15 (2): 81-85.
- 13. Osvaldo PA, Kieran McPaul, Hankey GJ et al. Homocysteine and depression in later life. Arch Gen Psychiatry 2008; 65(11): 1286-1294.
- 14. Bottiglieri T. Homocysteine and folate metabolism in depression. Prog Neuropsychopharmacol Biol Psychiatry 2005; 29: 1103-1112.
- 15. Savage DG, Lindenbaum J, Stabler SP, Allen RH. Sensitivity of serum methylmalonic acid and total homocysteine determinations for diagnosing co-balamin and folate deficiencies. Am J Med 1994; 96: 239-246.
- 16. Green R. Indicators for assessing folate and vitamin B-12 status and for monitoring the efficacy of intervention strategies. Am J Clin Nutr 2011; 94: 666S-672S.
- 17. Bottiglieri T, Laundy M, Crellin R, Toone BK, Carney MW, Reynolds EH. Homocysteine, folate, methylation, and monoamine metabolism in depression. J Neurol Neurosurg Psychiatry 2000; 69: 228-232.
- 18. Mattson MP, Shea TB. Folate and homocysteine metabolism in neural plasticity and neuro degenerative disorders. Trends Neurosci 2003; 26: 137-146.
- 19. Refsum H, Nurk E, Smith AD, Ueland PM, Gjesdal CG, Bjelland I, Tverdal A, Tell GS, Nygärd O, Vollset SE. The Hordaland Homocysteine Study: a community-based study of homocysteine, its determinants, and associations with disease. J Nutr 2006; 136: 1731S-1740S.
- 20. Mudd SH, Finkelstein JD, Refsum H, Ueland PM, Malinow MR et al. Homocystein and its bisulfide derivatives: a suggested konsensus terminology. Aterioscler Tromb BASF Biol 2000; 20: 1704-1706.
- 21. Finkelstein JD. Inborn errors of sulfur-containing aminoacid metabolism. J Nutr 2006; 136: 1750S-1754S.
- 22. Miller AL: The methionine-homocysteine cycle and its effects on cognitive diseases. Alter Med Rev 2003; 8: 7-19.
- 23. Brown AS, Susser ES. Homocysteine and schizophrenia: from prenatal to adult life. Prog Neuropsychopharmacol Biol Psychiatry 2005; 29: 1175-1180.
- 24. Smith AD, Smith SM, de Jager CA, Whitbread P, Johnston C et al. Homocystein-lowering by B vitamins slows the rate of accelerated brain atrophy in mild cognitive impairment: a randomized controlled trial. PLoS One 2010; 5 (9): el2244.
- 25. Hooshmand B, Solomon A, Kareholt I, Leiviska J, Rudanem M et al. Homocysteine and holotranscobalamin and the risk od Alzheimer disease: a longitudinal study. Neurology 2010; 75:1408-1414.
- 26. Schnyder G, Rovci M, Flammer Y, Pin R, Hess OM: Effect of Homocysteine-lowering Therapy with Folic Acid, Vitamin B12 and Vitamin B6 on Clinical Outcome after Percutaneous Coronary Intervention. The Weiss Heart Study: a Randomised Controlled trial. JAMA 2002; 288: 973-979.
- 27.
- 28. Crellin R, Bottiglieri T, Reynolds EH: Folates and psychiatric disorders, Clinical potential. Druha 1993; 45: 623-636.
- 29. Carney MWP, Chary TKN, Laundy M et al. Red cell folate concentrations in psychiatric patients. J Affect Disord 1990; 19: 207-213.
- 30. Godfrey PSA, Toone BK, Carney MWP et al. Enhancement of recovery from psychiatric illness by methyl folate. Lancet 1990; 336: 392-395.
- 31. Coppen A, Chaudry S, Swade C: Folic acid enhances lithium prophylaxis. Journal of Affective Diseases 1986; 10: 9-13.
- 32. Reynolds EH, Carney MWP, Toone BK: Methylation and mood. Lancet 1984; ii: 196-98.
- 33. Trimble MR: Biological Psychiatry, 2nd ed. New York: J Wiley; 1996.
- 34. Bottigliery T, Hyland K, Laundy M et al. Folate deficiency, biopterin and monoamine metabolism in depression. Psychol Med 1992; 22: 871-876.
- 35. Bottigliery T, Hyland K, Reynolds EH. The clinical potential of ademetionine (S-adenosylmethionin) in neurological disorders. Drugs 1994; 48: 137-152.
- 36. Bottigliery T, Laundy M, Crellin R, Toone BK et al. Homocysteine, folate, methylation and monoamine metabolism in depression. J Neurol Neurosurg Psychiatry 2000; 69: 228-232.
- 37. Bottigliery T, Hyland K: S-adenosylmethionine levels in psychiatric nad neurological disorders: a review. Acta Neurol Scand Suppl 1994; 154: 19-26.
- 38. Botez MI, Young SN, Bachevalier J et al. Folate deficienty and decreased brain 5-hydroxytryptamine synthesi in man and rat. Nature 1979; 278: 182-183.
- 39. Botez MI, Young SN, Bachevalier J et al. The Effect of Folic Acid and Vitamin B12 deficiency on hydroxyindoleacetic acid in human cerebrospinal fluid. Ann Neurol 1982; 12: 479-484.
- 40. Ruck A, Kamer S, Metz J et al. Methyltetrahydrofolate is a potent and selective agonist for kainic acid receptors. Nature 1980; 287: 852-853.
- 41. Wang J, Andrews H, Thukral V. Presynpatic receptors regulate noradrenaline realease from isolated nerve terminals. J Neurochem 1992; 58: 204-211.
- 42. Fava M, Boms JS, Albert JE et al. Folate, B12 and Homocysteine in Major Depressive Disorder. Am J Pychat 1997; 154: 426-428.
- 43. Reynolds EH, Preece JM, Bailey J, Coppen A: Folate deficienty in Depressive Illness. Br J Psychiatr 1970; 117:287-292.
- 44. Alexopoulos GS, Meyers BS, Young RC, Campbell S et al. Vascular Depression hypothesi. Arch Gen Psychiatry 1997; 54 (10): 915-922.
- 45. Gariballa S: Testing homocysteine-in-duced neurotransmitter deficiency, and depression of mood hypothesis in clinical praktice. Age Ageing 2001, abstract.
- 46. Wolters M, Strohle A, Hahn A. Age-associated changes in the metabolism of vitamin B12 and folic acid: prevalence, aetiopathogenesis nad pathophysiological consequences. Gerontol Geriatr 2004; 37: 109-135.
- 47. Ueland PM, Refsum H: Plasma homocysteine, a risk factor for premature vascular disease: plasma levels in healthy persons during pathologic conditions and drug therapy. Nord Med 1989; 104: 293-298.
- 48. Van der Kooy, van Hout H, Marwijk H, Marten H et al. Depression and the Risk for Cardiovascular diseases: systematic review and meta analysis. Int J Geriatr Psychiatry 2007; Jan 19 (Epub ahead of print).
- 49. Tang HZ: The Changes of monoamine metabolites in CSF of patients with cerebral stroke. Zhonghua Shen Jing Jing Shen Ke Za Zhi 1991; 24: 130-132,186 (Chinese).
- 50. Bayer JB, Starkstein SE, Votypka V, Parikh RM et al. Reduction of CSF monoamine metabolites in poststroke depression: a preliminary report. J Neuropsychiatry Clin Neurosci 1992; 4:440-442.
- 51. Bressa GM. S-adenosyl-L-methionine (SAMe) as antidepressant: meta-analysis of clinical studies. Acta Neurol Scand Suppl 1994; 154: 19-26.
- 52. Morris MA. Homocysteine and Alzheimer's disease. Lancet Neurology 2003; 2: 425-428.
- 53. Clarke R, Smith AD, Jobst KA, Refsum H et al. Folate, vitamin B12 and serum total homocysteine levels in confirmed Alzheimer disease. Arch Neurol 1998; 55: 1449-1455.
- 54. Chen CS, Chou MC, Yeh C, Lai CL et al. Plasma homocysteine levels and major depressive disorders in Alzheimer disease. Am J Geriatr Psychiatry 2010; 18 (11): 1045-1048.
- 55. Fuh JL. Homocysteine cognition and brain white matter hyperintenzities. Acta Neurol Taiwan 2010; 19 (3): 150-152.
- 56. Morillas-Ruiz JM, Rubio-Perez JM, Albaladejo MD, Zafrilla P et al. Effect of an antioxidant drink on homocysteine levels in Alzheimer's patients. J Neurol Sci 2010; 299: 175-178.
- 57. Tu MC, Huang CW, Chen NC, Chang WN, Lui CC et al. Hyperhomocysteinemia in Alzheimer Dementia Patients and Cognitive Decline after 6 Months Follow-up Period. Acta Neurol Taiwan 2010; 19: 164-173.
- 58. Vogiatzoglou A, Refsum H, Johnston C, Smith SM, Bradley KM et al. Vitamin B12 status and rate of brain volume loss in community-dwelling elderly. Neurology 2008; 71: 826-832.
- 59. McCaddon A, Davies G, Hudson P, Tandy S et al. Total serum homocysteine in senile dementia of Alzheimer type. Int J Geriatr Psychiatry 1998; 13:235-39.
- 60. Ho PL, Ortiz, Rogers E, Shea TB. Multiple aspects of homocysteine neurotoxicity: glutamate excitotoxicity, kinase hyperactivation and DNA damage. J Neurosci Res 2002; 70: 694-702.
- 61. McCaddon A, Hudson P, Hill D et al. Alzheimer's disease and total plasma aminothiols. Biol Psychiatry 2003; 53: 254-260.
- 62. Cito A et al. Analysis of serum levels of homocysteine and oxidative stress markers in patients with Alzheimer disease. Biomedicine and Pharmacotherapy 2010; doi: 10.1016/j.biopha.2010.09.018.
- 63. Faraci FM, Lentz SR: Hyperhomocysteinemia, oxidative stress and cerebral vascular dysfunction. Stroke 2004; 35: 345-348.
- 64. Dwyer BE, Raina AK, Perry G, Smith MA. Homocysteine and Alzheimer's disease: a modifiable risk? Free Radic Biol Med 2004; 36: 1471-1475.
- 65. Selhub J, Jacques PF, Wilson PW, Rush D et al. Vitamin status and intake as primary determinants of homocysteinemia in an elderly population. JAMA 1993; 270: 2693-2698.
- 66. Nygard O, Vollset SE, Refsum H. Plasma homocysteine and cardiovascular risk profile: the Hordaland Homocysteine Study. JAMA 1995; 274: 1526-1533.
- 67. Clarke R, Woodhouse P, Ulvik A, Frost C, Sherliker P et al. Variability and determinants of total homocysteine concenrations in plasma in an elderly population. Clin Chem 1998; 44: 102-107.
- 68. Nilsson K, Gustafson L, Hultberg B. Plasma homocysteine and vascular disease in elderly patients with mental illness. Clin Chem Lab Med 2008; 46 (11): 1556-1561.
- 69. Forti P, Rietti E, Pisacane N, Olivelli V et al. Blood homocysteine and risk of depression in the elderly. Archives of Gerontology and Geriatrics 2010; 51: 21-25.
- 70. Alexopoulos GS. Vascular disease, depression and dementia. J Am Geriatr Soc. 2003; 51: 1178-1180.
- 71. Alexopoulos GS. The Vascular depression hypothesis: 10 years later. Biol Psychiatry 2006; 60: 1304-1305.
- 72. Folstein M, Liu T, Peter I, Buell J, Arsenault L, Scott T et al. The homocysteine hypothesis of depression. Am J Psychiatry 2007; 164: 861-867.
- 73. Hooshmand B, Solomon A, Káreholt I, Rusanen M, Hänninen T, Leiviská J et al. Associations between serum homocysteine, holotranscobalamin, folate and cognition in the elderly: a longitudinal study. J Intern Med 2012; 271: 204-212.
- 74. Doraiswamy PM. Non-cholinergic strategies for treating and preventing Alzheimer's disease. CNS Drugs 2002; 16:811-824.
- 75. Connelly PJ, Prentice NP, Cousland G, Bonham J. A randomised double-blind placebo-controlled trial of folic acid supplementation of cholinesterase inhibitors in Alzheimer's disease. Int J Geriatr Psychiatry 2008; 23: 155-160.
- 76. de Jager CA, Oulhaj A, Jacoby R, Refsum H, Smith AD. Cognitive and clinical outcomes of homocysteine-lowering B-vitamin treatment in mild cognitive impairment: a randomized controlled trial. Int J Geriatr Psychiatry 2012; 27: 592-600.





